Exkurs – A
Chemie – gar nicht so schwer!
|
Die folgenden Inhalte können dazu beitragen, dass – dir einige Grundlagen der Chemie wieder einfallen, Dieser Exkurs ersetzt keinen Chemieunterricht! Die ausgewählten Inhalte sind bewusst an vielen Stellen vereinfacht und verkürzt dargestellt. Das sollte jedoch reichen, alte Kenntnisse wieder aufzufrischen und das Verständnis chemisch-biologischer Sachverhalte zu erleichtern. Es wurde versucht die chemischen Inhalte so verständlich wie möglich darzustellen bzw. zu erklären. Inhalte: |
Du kannst folgendermaßen vorgehen:
Alternative A: Wenn du meinst, dass du eine grundlegende „Runderneuerung“ deiner Chemiekenntnisse haben müsstest, arbeite diesen Exkurs durch. Am Ende eines jeden Abschnittes findest du Aufgaben. Versuche sie zu lösen – das trägt zum besseren Behalten bei!
Alternative B: Wenn du meinst, nur gelegentlich etwas unsicher hinsichtlich deiner Chemie-Grundkenntnisse zu sein, dann nutze diesen Exkurs, wenn du im Haupttext oder in den Arbeitsblättern auf Inhalte der Chemie triffst, die dich stutzig machen. Versuche die am Ende eines jeden Abschnittes gestellten Aufgaben zu lösen. Damit überprüfst du dein Verständnis der Inhalte.
😆 Viel Spaß – ja, auch das!
1. Atome und Elemente
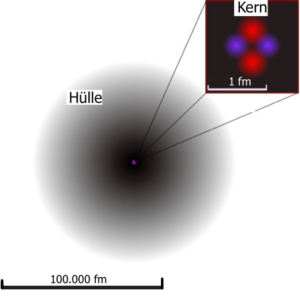
Kann man Atome eigentlich sehen?„Jein“, durch den Einsatz spezieller Verfahren kann man Atome sichtbar machen, sehen kann man sie nicht. Abbildungen von Atomen (Abb. EA_1-1) sind dann ein Ergebnis der Auswertung von Messdaten und weiterer digitaler Bearbeitung. Die Größenverhältnisse in der Abbildung rechts sind auch nicht maßstabsgetreu. Im Vergleich zum Atom-Kern hätte die Atomhülle einen Durchmesser von etwa 5 Metern. Um eine weitere Vorstellung von der Größe eines Atoms zu erhalten müsste man ein DIN A4-Blatt 32-mal der Breite nach in zwei Hälften zerreißen, um einzelne Atome zu erzeugen. Hört sich nicht viel an, aber viel Spaß beim Ausprobieren!
|
|
Wenn man also in Zusammenhang mit Atomen immer mit Modellvorstellungen arbeitet, hat dieses vor allem seine Ursache in der Winzigkeit von Atomen. Für das weitere Vorgehen ist es hilfreich, zunächst zwei – vereinfachte – Definitionen kennenzulernen:
Atom (griech.: átomos „unteilbar“) Ein Atom ist ein mit chemischen Mitteln nicht weiter zerlegbares Teilchen.
Element Ein Element besteht aus gleichen Atomen. Elemente werden auch als Reinstoffe bezeichnet, sie lassen sich nicht in andere Stoffe zerlegen. Elemente sind fest, flüssig oder gasförmig.
Bereits im Altertum gab es die Vorstellung, dass Materie aus unveränderlichen Grundbausteinen aufgebaut ist. Der wichtigste Vertreter dieser Auffassung war der Philosoph Demokrit (ca. 460-371 v. Chr.). Er vertrat die Meinung, dass die gesamte Natur aus kleinsten, nicht weiter unterteilbaren Einheiten, den Atomen (griech.: átomos / unteilbar) zusammengesetzt ist.
Im Jahre 1808 veröffentlichte der Philosoph und Naturwissenschaftler J. Dalton (1766 – 1844) seine Hypothesen zum Aufbau von Stoffen.
Sie besagten, dass
- alle Elemente aus bestimmten kugelförmigen Teilchen, den Atomen bestehen,
- die Atome weder zerstört noch neu erschaffen werden können,
- Atome bei chemischen Reaktionen neu angeordnet werden.
Es dauerte fast 100 Jahre, bis Wissenschaftler weitergehende Vorstellungen von Atomen schufen. Das Neue war vor allem die weitere Unterteilung der Atome in positive und negative Teilchen.
Der Physiker J.J. Thomson entwickelte 1903 aufgrund von Experimenten das erste naturwissenschaftliche Atommodell, das sogenannte „Plumpudding-Modell (= Rosinenkuchen-Modell)“. Danach besetzen negative Elektronen (= Rosinen) einen insgesamt positiven Raum (= Teigmasse).
E. Rutherford (1871 – 1937) veröffentlichte seine Vorstellungen zum Atombau im Jahre 1911. Er entwickelte selbst kein Atommodell, aber aus seinen Erkenntnissen lässt sich ein Modell ableiten, das als „Kernhüllen-Modell“ oder „Elektronenhüllen-Modell“ bezeichnet wird. Auf der Grundlage von Experimenten zog er die Schlüsse, dass
- nahezu die gesamte Masse eines Atoms in dem Atomkern konzentriert ist,
- dieser Kern positiv geladen ist und
- die fast massefreie Atomhülle von Elektronen umkreist wird.
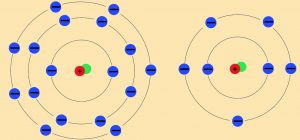
Die Vorstellungen von Nils Bohr (1885 – 1962) zum Atombau stammen aus dem Jahre 1913. Er entwickelte das sogenannte „Schalenmodell“ (Abb. EA_1-4).
Nach seiner Theorie
- gibt es mehrere schalenartige Räume, in denen sich die Elektronen um den Atomkern herum bewegen,
- enthalten diese Schalen jeweils eine unterschiedliche Anzahl von Elektronen, wobei deren Anzahl von innen nach außen zunimmt.
Bohr verwendete bereits die beiden Begriffe „Proton“, als positiv (+) geladenes und „Elektron“ als negativ (-) geladenes Teilchen. Das „Neutron“ war noch nicht bekannt. Der Physiker J. Chadwick (1891 – 1974) entdeckte dieses Teilchen erst im Jahre 1932 und erhielt 1935 dafür den Nobelpreis für Physik.
Für die weitere Arbeit in diesem Exkurs wird meistens der gedankliche Ansatz von Nils Bohr – natürlich unter Einbeziehung der Neutronen – benutzt.
Im Rahmen der Weiterentwicklung von Atommodellen ist das „Kugelwolkenmodell“ (Abb. EA_1-4) zu nennen. In diesem Modell wird davon ausgegangen, dass sich die Elektronen in einem Raum um den Atomkern herum bewegen. Dabei ist nicht berechenbar, zu welchem Zeitpunkt sie sich an welchem Ort in diesem Raum befinden.
Eine Analogie soll dieses verdeutlichen: Insekten umschwirren nachts eine Lampe. Einerseits zieht das Licht der Lampe die Insekten an, andererseits verhindert die Wärme der Lampe, dass die Insekten sich dort niederlassen. Die Insekten schwirren deshalb unvorhersehbar in wechselnden Entfernungen um die Lampe herum.
In der folgenden Abbildung (Abb. EA_1-4) werden die in allen organischen Stoffen vorkommenden Atome Wasserstoff (H), Kohlenstoff (C) und Sauerstoff (O) jeweils als Schalen-Modell und Kugelwolkenmodell dargestellt. Außerdem werden zwei übliche Schreibweisen dieser Atome angegeben.
Hinweis: Zum Verständnis beider Modellabbildungen ist es notwendig, sich vorzustellen, dass die Realität in einem dreidimensionalen Raum stattfindet und mit ständiger Bewegung der Elektronen verbunden ist.
Die sich anschließende Legende soll helfen, die Darstellungen bzw. Schreibweisen besser zu verstehen.
| Legende / Erklärungen: | ||||||||
 |
Das Proton ist ein positiv geladenes Teilchen (p+) im Atomkern. Die Anzahl der Protonen wird bei der symbolischen Schreibweise der Elemente in Form der „Ordnungszahl (Z)“ angegeben. Die Anzahl der Protonen macht jedes Atom / Element einzigartig im Vergleich zu anderen Elementen. Die Anzahl der Protonen stimmt im Normalfall mit der Anzahl der Elektronen überein.Hinweis: In diesem Exkurs wird in den folgenden schematischen Abbildungen von Atomen immer nur ein Proton-Symbol eingezeichnet, unabhängig von deren Anzahl! |
|||||||
 |
Das Neutron ist ein ungeladenes Teilchen (n) im Atomkern. In der symbolischen Schreibweise der Elemente gibt die „Massenzahl (A)“ die Summe der Protonen und Neutronen an.
Hinweis: In diesem Exkurs wird in den folgenden schematischen Abbildungen von Atomen immer nur ein Neutron-Symbol eingezeichnet, unabhängig von deren Anzahl! Zwischen Neutronen und Protonen wirken Kräfte, die den Zusammenhalt des Kerns bewirken. |
|||||||
 |
Ein Elektron ist ein negativ geladenes Teilchen (e-), das sich in unterschiedlicher Entfernung zum Atomkern im Raum bewegt. Aufgrund seiner negativen Ladung besteht eine Anziehungskraft zwischen ihm und dem positiv geladenen Atomkern. Die Elektronen auf der äußersten Schale heißen „Valenzelektronen“. Die Anzahl der Valenzelektronen bestimmen maßgeblich das chemische „Verhalten“ des betreffenden Atoms. Bei chemischen Reaktionen spielen die Elektronenaufnahme bzw. -abgabe zwischen den beteiligten Atome eine entscheidende Rolle. |
|||||||
 |
Das „Schalenmodell“ und das „Kugelwolkenmodell“ stellen auf unterschiedliche Art und Weise den Aufenthalt der Elektronen dar.
Beim Schalenmodell wird davon ausgegangen, dass die Elektronen sich auf einer festen Bahn (= Schale) bewegen.
Die maximale Anzahl von Elektronen kann nach folgender Formel bestimmt werden: 2 n2 (n steht dabei für die Nummer der Schale)
Bei Darstellung in Form des Kugelwolkenmodells werden oft nur die äußeren Kugelwolken dargestellt, da nur sie in Zusammenhang mit den Eigenschaften des betreffenden Atoms von Bedeutung sind. Der folgender Link hilft bei der Veranschaulichung des Kugelwolkenmodells.
|
|||||||
 |
Symbolschreibweise:
Das „Elementsymbol (X)“ wird als Kurzschreibweise für das einzelne Atom verwendet und besteht aus einem oder zwei Buchstaben. |
|||||||
 |
Valenzstrichschreibweise: Das „Elementsymbol (X)“ wird als Kurzschreibweise für das einzelne Atom verwendet und besteht aus einem oder zwei Buchstaben. Einzelne Valenzelektronen werden als Punkt, Valenz-Elektronenpaare als Strich dargestellt. |
|||||||
Neuere Atommodelle, die aufgrund von Erkenntnissen der Quantenphysik entwickelt wurden, werden hier nicht berücksichtigt. Wer sich dafür interessiert, kann sich z.B. über folgenden Links darüber informieren.
| |
http://www.leifiphysik.de (Zugriff: 2016-05-13) https://www.grund-wissen.de/physik/atomphysik/atommodelle.html (Zugriff: 2019-05-18) https://www.weltderphysik.de/gebiet/teilchen/atome-und-molekuele/atome-und-quantenphysik/ (Zugriff: 2019-05-10) http://physikunterricht-online.de/jahrgang-12/quantenmechanisches-atommodell/ (Zugriff: 2016-05-13) |
2. Isotope
Eine Fußballmannschaft ist eine Gruppe von Menschen, die sich hinsichtlich ihres Zieles, nämlich Tore zu schießen, ähneln. Genauer betrachtet hat jedoch jedes einzelne Mannschaftsmitglied spezifische Eigenschaften und Aufgaben: Torwart, Verteidiger, Stürmer etc. Ähnliches gilt für die Isotope eines Atoms: Alle Isotope eines Atoms haben die geiche Ordnungszahl, also gleich viele Protonen und stehen damit für das gleiche Element. Allerdings hat jedes Isotop eines Elements unterschiedlich viele Neutronen. Das Verhalten der Isotope eines Atoms bzw. Elements ist trotz dieser Unterschiede ähnlich.
Natürlicherweise hat z.B. jedes Kohlenstoffatom 6 Protonen und 6 Elektronen, ansonsten wäre die elektrische Neutralität nicht zu erhalten. Die Anzahl der Neutronen und damit auch die Größe der Massenzahl können jedoch variieren. Ist dieses der Fall, spricht man von Isotopen.
Isotope (griech.: iso „gleich“ / topos „Ort“) Isotope sind die zu einem chemischen Element gehörenden Atome gleicher Ordnungszahl, aber verschiedener Anzahl von Neutronen und damit anderer Massenzahl.
Die Schreibweise der Isotope ähnelt der bereits kennen gelernten Atom-Symbolschreibweise (siehe Abb. EA_1-4). Die Ordnungszahl wird bei Isotopen jedoch meistens weggelassen. Oft wird auch an das Elementsymbol einfach mit Bindestrich die Massenzahl des Isotops angefügt (Beispiel: Kohlenstoffisotop 14C oder C-14 ). Jedes Element weist eine unterschiedliche Anzahl von möglichen Isotopen auf. Wenn mehrere Isotope vorkommen, wird eine Art Mittelwert aus allen Isotopen gebildet. Dadurch weicht die Massenzahl von ganzzahligen Werten etwas ab. (siehe Periodensystem / Abb. EA_3-1).
Meistens ist es aber noch möglich, die zuvor bereits genannte Regel einzuhalten: Massenzahl minus Ordnungszahl = (durchschnittliche) Anzahl der Neutronen. Bei der Mehrzahl der Elemente gibt es ein „Hauptisotop“, z. B. beim Sauerstoff das Isotop 16O mit einem Anteil von 99,76 % an allen Sauerstoffisotopen. Auf die genauen Ursachen der Entstehung von Isotopen wird hier nicht weiter eingegangen. Es sei nur so viel gesagt, dass es sich um Naturprozesse handelt, bei denen auch kosmische Strahlung eine Rolle spielen kann. Wie Kenntnisse über Isotope genutzt werden können, zeigt die Aufgabe 4 am Ende des folgenden Abschnittes.
3. Periodensystem
Für die Naturwissenschaften ist es üblich, Dinge zu ordnen. Dementsprechend werden die Elemente bzw. ihre Atome im „Periodensystem“ geordnet dargestellt. Das zugrunde liegende Ordnungsprinzip folgt der Protonenanzahl.
Periodensystem (griech.: periodos „Umlauf, Wiederkehr“ ; system „aus mehreren Teilen zusammengesetztes Ganzes“ / engl.: periodic system) Das Periodensystem der Elemente (PSE) ist eine Anordnung der chemischen Elemente nach steigender Protonen-(Kernladungs-) zahl. Diese ist bei normalen (=neutralen) Atomen gleich der Zahl der Elektronen in der Atomhülle. Die Anordnung der Elemente in waagrechten Perioden und senkrechten Gruppen spiegelt die Elektronenbesetzung der Schalen wider.

Abb. EA_3-1 Periodensystem der Elemente und ihre biologische Bedeutung verändert nach Prof. D. Rehder / Anorganische Chemie für Biologen / Script 2006 / Uni Hamburg
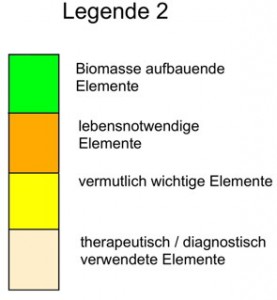 Abb. EA_3-1a biologische Betrachtungsweise des PSE |
Wer das hier aufgezeigt PSE aufmerksam betrachtet, findet noch einen weiteren Unterschied zu anderen Darstellungsarten dieses Ordnungssystem. Die Kennzeichnung bestimmter Elemente mit unterschiedlichen Farben erfolgt unter dem Gesichtspunkt einer biologischen Betrachtungsweise. Diese Vorgehensweise hat ihren Ursprung in einem Wissenschaftszweig der Chemie, der „Bioanorganischen Chemie“. Sie beschäftigt sich mit der Bedeutung der Elemente in Zusammenhang mit biologischen Sachverhalten bzw. Prozessen.Wen es interessiert, der findet weitere Informationen dazu auf dem Arbeitsblatt AB EA_1 „Bioanorganische Chemie – ein Widerspruch?“ |
Das Periodensystem (Abb. EA_3-1) enthält horizontale und senkrechte Zeilen. Die Elemente einer jeden Hauptgruppe (senkrecht) weisen die gleiche Elektronenanzahl in der äußersten Schale (= Valenzelektronen) auf. Die äußerste Schale bestimmt wesentlich die chemischen Eigenschaften eines Atoms. Damit besitzen die Elemente derselben Hauptgruppe eine Ähnlichkeit bezüglich ihrer chemischen Eigenschaften. Die Elemente einer jeden Periode (waagerecht) befinden sich in der gleichen Zeile. Mit wachsender Periode nimmt die Anzahl der mit Elektronen besetzten Schalen zu. Innerhalb einer Periode nimmt in der Regel von links nach rechts auch die Anzahl der positiv geladenen Protonen im Atomkern zu und ebenso die Anzahl der negativ geladenen Elektronen in der/den Atomhülle/n. Leider gibt es in der Darstellung des Periodensystems keine Einheitlichkeit. Obwohl die Symbolschreibweise vorschreibt, die Massenzahl links oben und die Ordnungszahl links unten neben dem Symbol zu notieren, zeigen die PSE-Tabellen diesbezüglich manchmal andere Anordnungen – nicht irritieren lassen, die jeweilige Legende anschauen! Außerdem sind häufig noch weitere Angaben in dem Element-Feld aufgeführt. In dem hier dargestellten PSE wurde nach der in Abbildung EA_1-4 angegebenen Symbolschreibweise verfahren.
|
||
|
||
|
||
|
||
|
||
| Wer Interesse hat, findet unter dem folgenden Link ein sehr vielfältiges und ausführliches interaktives Periodensystem: http://www.ptable.com/ (Zugriff: 24.04.14) Für Fortgeschrittene: http://www.periodensystem-online.de/ (Zugriff: 24.04.14) http://www.seilnacht.com/Chemie/ch_index.htm (Zugriff: 2014-10-14) |
4. Moleküle
Die Elemente sind gewissermaßen das „Ausgangsmaterial“ für alle unbelebten und belebten Dinge, die uns und unsere Umwelt aufbauen und prägen. Die damit verbundene Vielfalt wäre kaum möglich, wären dafür die Elemente in Reinform – so wie sie im PSE vorkommen – verantwortlich. Die Vielfalt ergibt sich erst aus dem Zusammenschluss von Atomen verschiedener, manchmal auch gleicher Elemente. Diesen Zusammenschluss bezeichnet man allgemein als „Verbindung“. Das entstandene Produkt nennt man „Molekül“.
Molekül (lat.: molecula „kleine Masse“ / engl.: molecule) Ein Molekül ist ein zwei- oder mehratomiges Teilchen, das aufgrund von Bindungen zusammengehalten wird. In der Regel ist ein Molekül elektrisch neutral.
Auch in Zusammenhang mit den Nährstoffen ist häufiger der Begriff „Makromolekül“ zu lesen.
Makromolekül (griech.: makros „groß, weit, lang“)
Dieser Begriff kennzeichnet ein sehr großes Molekül („Riesenmolekül“), das durch die Verbindung vieler gleicher oder ähnlicher Molekül-Bausteine zustande kommt. Die Massen der einzelnen Molekülbausteine sind im Vergleich zur Masse des Makromoleküls sehr klein.
In Hinblick auf die Nährstoffe fallen damit unter diese Molekülkategorie lediglich die Polysaccharide (Kap. 2.1) und die Proteine (Kap. 2.3). Weitere Beispiele für Makromoleküle sind die Nucleinsäuren DNA und RNA.
Heute wird der Begriff hauptsächlich in Zusammenhang mit künstlichen Makromolekülen verwendet. Dabei handelt es sich vor allem um Kunststoffe.
Ein ähnlicher Begriff ist „Polymer“ (griech.: poly „viele“ , meros „Teil“).
Anmerkung:
Der Begriff „Makromolekül“ ist nicht zu verwechseln mit der Bezeichnung „Makronährstoff“. Bei den „Makronährstoffen“ handelt es sich um die hauptsächlichen Bestandteile, die den menschlichen Körper aufbauen ( Kohlenhydrate, Fette und Eiweiße). „Mikronährstoffe“ sind weitere dem Körper zuzuführende Stoffe, die zur Aufrechterhaltung der Lebensfunktionen notwendig sind (Mineralstoffe, Vitamine undSpurenelemente).
4.1 Schreibweisen
Im Folgenden werden die Grundlagen verschiedener Schreibweisen von Molekülen anhand von Beispielen erklärt und deren Anwendung benannt. Besonderheiten, die in vielen Fällen zu beachten sind, bleiben hier unberücksichtigt und sind im Chemieunterricht zu klären!
Summenformel
Die Summenformel gibt die beteiligten Atome und deren Anzahl wieder. Diese Art der Darstellung ermöglicht einen schnellen Überblick über die Zusammensetzung von Molekülen.
Sie ist u.a. Grundlage für das Erstellen von Reaktionsgleichungen
Beispiele:
Wasser / H2O: besteht aus 2 Wasserstoffatomen und 1 Sauerstoffatom
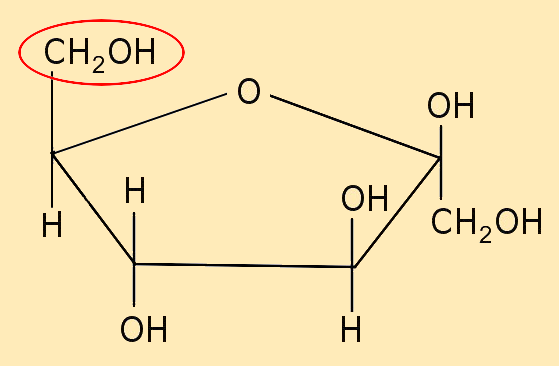
Glucose / C6H12O6 : (Traubenzucker) besteht aus 6 Kohlenstoffatomen, 12 Wasserstoffatomen und 6 Sauerstoffatomen
Elektronenformel (Lewis-Formel)
Ausgangspunkt ist in der Regel die Summenformel. Die Lewis-Formel zeigt vom Aufbau eines Atoms/Moleküls nur die einzelnen Valenzelektronen (= Anzahl der Elektronen auf der äußersten Schale) in Form von Punkten. Alle Elektronen, die auf den inneren Schalen liegen bleiben unberücksichtigt, ebenso der Aufbau des Atomkerns. Diese Schreibweise ermöglicht vor allem einen schnellen Überblick über denkbare Atombindungen.
| Beispiele: Kohlenstoffdioxid hat die Summenformel CO2. Zum Aufstellen der Lewis-Formel wird zunächst die Zahl der Valenzelektronen bestimmt. Kohlenstoff (C) steht im PSE in der vierten Hauptgruppe. Es besitzt also vier Valenzelektronen. Sauerstoff (O) steht im PSE in der sechsten Hauptgruppe und hat dementsprechend sechs Valenzelektronen (siehe Abb. EA_3-1) . |
 |
| Es ist nun zu prüfen, ob die Elektronen/-paare so zu verteilen sind, dass jedes der drei Atome des Kohlenstoffdioxids acht Elektronen auf seiner Außenschale nutzen kann.Das Ergebnis sieht folgendermaßen aus: |  |
Valenzstrichformel
| Die Valenzstrichformel leitet sich von der Elektronenformel ab. Die Vorgehensweise erfolgt zunächst entsprechend.Zwischen den an der Bindung beteiligten Atomen wird je ein Valenzelektron der beiden beteiligten Atome durch einen Strich miteinander verbunden. Durch den Bindungsstrich wird deutlich, dass beide betroffene Valenzelektronen beiden Atomen zuzuordnen sind. Es handelt sich um ein bindendes Elektronenpaar. Treten zwei nebeneinander liegende, bindende Elektronenpaare auf, spricht man von einer Doppelbindung. Werden zwei gedachte Elektronen mit einem Strich verbunden, der nicht zwischen zwei Atome liegt, handelt es sich um ein freies Elektronenpaar. Bei einem freien Elektronenpaar handelt es sich um zwei der Valenzelektronen, die nicht an der Bindung zwischen den Atomen beteiligt sind.Die Bedeutung der Valenzstrichformel liegt in der zweidimensionalen, gut lesbaren Darstellung von Molekülen. |
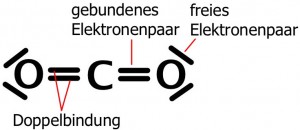 |
Kettenformel (Fischer-Projektion)
Diese Art der Darstellung berücksichtigt auch die Grundsätze der Valenzstrichdarstellung. Die Kettenformel basiert auf den Regeln der so genannten Fischer-Projektion. Diese von E. Fischer am Ende des 19.Jh. festgelegten Regeln sind ein Hilfsmittel, um räumliche Strukturen von Molekülen zweidimensional vorstellbar zu machen. Zum Beispiel führt eine dieser Regeln dazu, die C-Atome bestimmter Moleküle von oben nach unten durchzunummerieren.
|
| Ringformel (Haworth-Formel)
Verschiedene Kohlenhydrate können als Kettenform, aber auch als Ringform vorliegen. In den 30er Jahren des letzten Jahrhunderts befasste sich der Chemiker W.N. Haworth damit, wie man diese 5- bzw. 6-gliedrigen Moleküle grafisch als Ringformel darstellen könnte.Unter anderem stellte er dazu folgende Regeln auf:
Häufig erfolgt die Darstellung in Ringform vereinfacht: Die in den Ecken vorhandenen C-Atome werden nicht extra eingetragen. Die Durchnummerierung kann auch unterbleiben, da man ja die entsprechende Regel kennt. |
Reaktionsgleichung Viele Stoffe können miteinander reagieren. Man spricht dann von einer chemischen Reaktion.
Reaktion (lat.: reactio „Rückhandlung“) Bei einer chemischen Reaktion entsteht/en aus mindestens zwei Ausgangssubstanzen (Edukten) eine/mehrere neue Substanz/en (Produkt/e). Die Eigenschaften der Produkte unterscheiden sich von denen der Edukte. Bei allen Reaktionen spielt Energie eine wichtige Rolle.
Die Darstellung einer chemischen Reaktion erfolgt in Form einer Reaktionsgleichung. Grundsätzlich ist zu beachten, dass
- es sich bei der Reaktion nur um eine Um-/Neuverteilung der beteiligten Atome handelt, alte Bindungen werden aufgebrochen, neue Bindungen entstehen;
- auf der linken Seite der Gleichung immer die Ausgangssubstanz (Edukte) stehen;
- auf der rechten Seite immer der/die entstandene/n neue/n Substanz/en (Produkt/e) steht/en;
- die reagierenden Ausganzsubstanzen durch ein Pluszeichen miteinander verbunden werden, ebenso mehrere neu entstandene Substanzen;
- zwischen beiden Seiten immer ein Pfeil gezeichnet wird, der den Verlauf der Reaktion von Edukt(-en) zu Produkt(-en) anzeigt; ein zweiter Pfeil in die entgegengesetzte Richtung zeigend, weist darauf hin, dass das Produkt(-e) auch wieder Edukt(-e) sein kann / können;
- manchmal eine zusätzliche Information zum Ablauf der Reaktion über dem Pfeil notiert wird;
- sich auf der linken und rechten Seite der Gleichung immer die gleiche Anzahl von Atomen befinden müssen.
Die einfachste Form einer Reaktionsgleichung ist die „Wortgleichung“, zum Beispiel:
![]()
Sicherlich enthält auch die Wortgleichung wertvolle Informationen. Will man jedoch Genaueres darüber erfahren, sollte man im nächsten Schritt die beteiligten Stoffe jeweils in Form der Symbolschreibweise notieren, hier:
![]()
Die Gleichung besagt, dass die Edukte aus zwei Atomen Wasserstoff und zwei Atomen Sauerstoff bestehen und ein Produkt entsteht, das sich aus zwei Atomen Wasserstoff sowie nur einem (!) Atom Sauerstoff zusammensetzt. Dieses entspricht nicht den Regeln (s.o.). Man stelle sich eine Wippe vor: Bezüglich der „Menge“ der Atome, würde sie in diesem Fall eindeutig nach links kippen.
Nun beginnt ein oft ausprobierendes Suchen nach geeigneten „Koeffizienten“, d.h. Werten, die den einzelnen Edukten und Produkten vorangestellt werden und dazu führen, dass auf beiden Seiten die Anzahl der Atome identisch ist. Die gefundenen Zahlen werden vor die Edukte bzw. Produkte geschrieben. In diesem Fall lautet die Lösung:
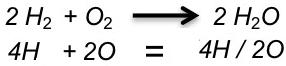 Dass nun als Produkt zwei Moleküle Wasser auftauchen ist kein Problem!
Dass nun als Produkt zwei Moleküle Wasser auftauchen ist kein Problem!
4.2 Bindungen
chemische Bindung / engl: chemical bond In einer chemischen Bindung sind zwei oder mehrere Atome aneinander gebunden. Grundlage sind Wechselwirkungen zwischen den Atomen.
Die Wechselwirkungen zwischen den Atomen bestehen häufig im Austausch von Valenzelektronen oder in deren gemeinsamer Nutzung. Zusätzlich gibt es noch andere Wechselwirkungen, wie z.B. die Wasserstoffbrückenbindung. In Zusammenhang mit biologischen Prozessen spielen Enzyme bei sehr vielen Wechselwirkungen zwischen Atomen eine entscheidende Rolle. Ausführliche und vertiefte Informationen über Bindungen findest du z.B. hier: https://de.wikibooks.org/wiki/Organische_Chemie_für_Schüler (Zugriff: 2014-04-24)
4.2.1 Atombindung – allgemein (= kovalente Bindung =Elektronenpaarbindung) / Polarität
Der Aufbau der Atome (siehe Abb.EA_1-4 ) und das Periodensystem zeigen, dass die äußere Schale jedes Atoms mit einer unterschiedlichen Anzahl von Elektronen besetzt ist. Bei der Atombindung geht es oft darum, dass die sich zusammenfindenden Atome „bestrebt“ sind, ihre jeweils äußerste Schale aufzufüllen. Wird dieses erreicht, liegt eine stabile Verbindung vor. Dabei ist folgende Regel (ab der zweiten Periode) zu beachten: Mit Ausnahme von Helium haben alle Edelgase (Hauptgruppe VIII) acht Elektronen auf ihrer äußeren Schale. Atome anderer Elemente streben* bei Reaktion an, ihre äußere Schale ebenfalls mit acht Elektronen aufzufüllen (= Edelgasregel).
* „streben an“ bedeutet nicht, dass die Atome selbst irgendeine „innere Kraft“ besitzen. Ursache sind komplizierte physikalische Grundlagen.
|
|
| Genaueres über die Edelgasregel findest du z.B. hier: http://www.u-helmich.de/che/EF/atom/atombau03.html (Zugriff: 2015-01-12) http://de.wikipedia.org/wiki/Edelgasregel (Zugriff: 2015-01-02) |
In den folgenden Aufgaben kann man den Umgang mit Atombindungen am Beispiel des Glucose-Moleküls üben.Falls Probleme auftauchen, helfen Inhalte der zurückliegenden Seiten (Abschnitte Atomaufbau, Periodensystem) und auch ein zusätzliches Hilfe-Blatt. 🙂 Einfach mal versuchen! Bitte lies zunächst alle drei Aufgabenstellungen.
|
| Abb. EA_4.2-1 / 1 „Das H-Atom ist bestrebt, seine K-Schale mit einem zweiten Elektron aufzufüllen. Es erhält dieses zweite Elektron durch die gemeinsame „Nutzung“ eines Elektrons des C-Atoms auf dessen L-Schale. Das C-Atom verfügt damit auf seiner L-Schale nun über fünf Elektronen.“ Abb. EA_4.2-1 / 2 „Der gleiche Prozess führt dazu, dass das „untere“ H-Atom ebenfalls seine K-Schale mit dem notwendigen Elektron auffüllen kann. Das C-Atom verfügt damit auf seiner L-Schale nun über sechs Elektronen.“ Abb. EA_4.2-1 / 3 „Zwischen den beiden „unteren“ C-Atomen kommt es zu einer gemeinsamen Nutzung eines Elektrons auf ihrer L-Schale. Das „unterste“ C-Atom verfügt damit auf seiner L-Schale über sieben Elektronen.“ Abb. EA_4.2-1 / 4 „Zwischen dem „untersten“ C-Atom und dem O-Atom kommt es zu einer gemeinsamen Nutzung eines Elektrons auf ihrer L-Schale. Das „unterste“ C-Atom verfügt damit über die angestrebten acht Elektronen auf der L-Schale. Damit ist die Verbindung „aus Sicht“ des C-Atoms stabil. |
Die vorausgegangenen Ausführungen lassen den Eindruck entstehen, dass sich die Bindungselektronen bei der Elektronenpaarbindung immer genau in der Mitte zwischen den beiden beteiligten Atomen befinden. Dieses ist aber in der Regel nicht der Fall. Das oftmals auftretende Phänomen der Ungleichverteilung der negativ geladenen Bindungselektronen zwischen den beteiligten Atomen ist auf die unterschiedliche Elektronegativität eines jeden Atoms zurückzuführen.
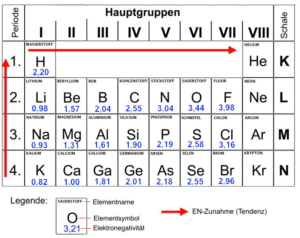
Elektronegativität (EN) ist ein Maß für die Fähigkeit eines Atoms, in einer Bindung das bindende Elektronenpaar an sich zu ziehen. Je größer der Zahlenwert der so genannten EN eines Atoms ist, desto stärker zieht dessen Atomkern die Bindungselektronen an sich heran.
Die Elektronegativität der Atome verschiedener Elemente ist sehr unterschiedlich. Ausschlaggebend für die EN ist die Kernladung (= Anzahl der Protonen) und der Durchmesser des jeweiligen Atoms, der im Wesentlichen von der Anzahl der vorhandenen Schalen abhängt.
Je größer die Kernladung und je geringer der Atomdurchmesser, desto elektronegativer ist das Atom, weil die negativ geladenen Elektronen umso stärker vom positiv geladenen Atomkern angezogen werden können.
Kernladung (= Anzahl der Protonen) und Anzahl der Schalen (= Periode) der Atome der verschiedenen Elemente sind Ordnungskriterien im Periodensystem, so dass sich auch die Veränderung der jeweiligen EN aus dem PSE ableiten lässt.
Der folgende Ausschnitt aus dem Periodensystem zeigt den jeweiligen Wert der EN für einzelne Atome.
Von Bedeutung sind die Werte der EN in Zusammenhang mit den Begriffen „unpolare“ und „polare“ Bindungen.
Was heißt das?
Wenn auch etwas verkürzt bzw. vereinfacht lässt sich Folgendes sagen:
- Die Bindungselektronen sind zwischen den beteiligten Atomen nahezu gleich verteilt, wenn die Differenz zwischen den beiden EN-Werten zwischen 0 und 0,4 liegt. Man spricht von einer „unpolaren“ Bindung.
- Die Bindungselektronen werden von einem der Bindungspartner deutlich stärker angezogen, sind also zwischen den beteiligten Atomen ungleich verteilt, wenn die Differenz zwischen den beiden EN-Werten zwischen 0,5 und 1,7 liegt. Man spricht von einer „polaren“ Bindung.
- Von einer „Ionenbindung“ (siehe auch Abschnitt 4.2.3) spricht man, wenn die Differenz zwischen den beiden EN-Werten größer ist als 1,7.
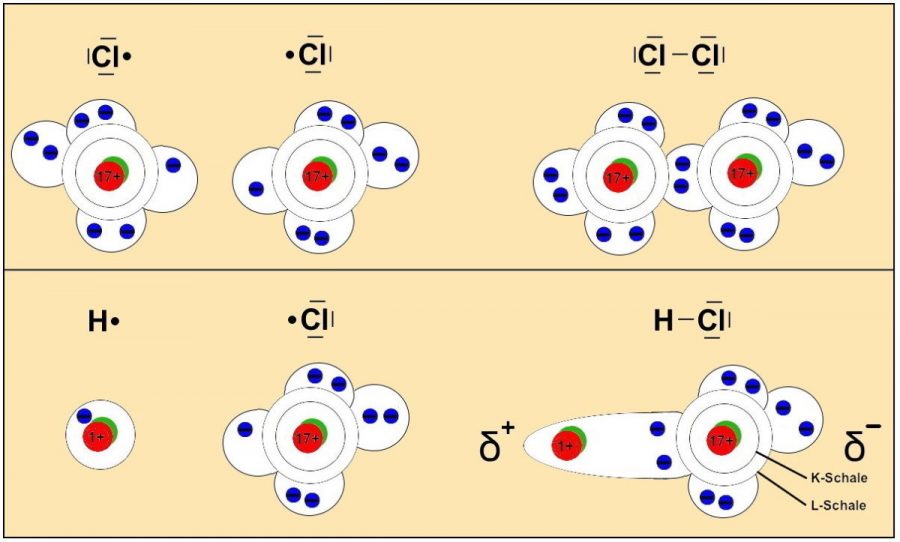
Die folgenden Abbildungen verdeutlichen modellhaft die Unterschiede zwischen einem unpolaren (z.B. Chlormolekül) und einem polaren Molekül (z.B. Chlorwasserstoffmolekül) in Zusammenhang mit einer Elektronenpaarbindung.
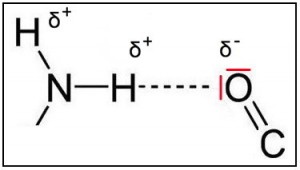
Beim Chlorwasserstoff liegt ein Molekül vor, das auf der „Chlorseite“ negativer und auf der „Wasserstoffseite“ positiver geladen ist, weil die Elektronen sich näher am Chlor-Atom und weiter entfernt vom Wasserstoff-Atom aufhalten. Die Ursache liegt darin begründet, dass das Chloratom eine höhere EN aufweist als das Wasserstoffatom (EN-Cl: 3,16 / EN-H: 2,20 / EN-Unterschied: 0,96). Chlorwasserstoff ist also ein polares Molekül. Gekennzeichnet wird diese Erscheinung durch den griechischen Kleinbuchstaben „Delta “ (δ+/ δ–).
Beim Auftreten von einem elektrisch positiv bzw. negativ geladenen Bereich in einem Molekül wird auch von einem „Dipol“ gesprochen. Das bekannteste Dipol-Molekül ist Wasser (siehe auch Kap. 2.4).
|
| Lösungen Aufg. 16-18:
zu 16. |
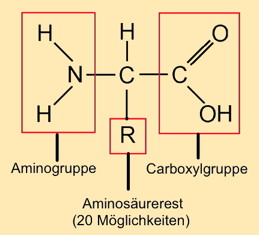
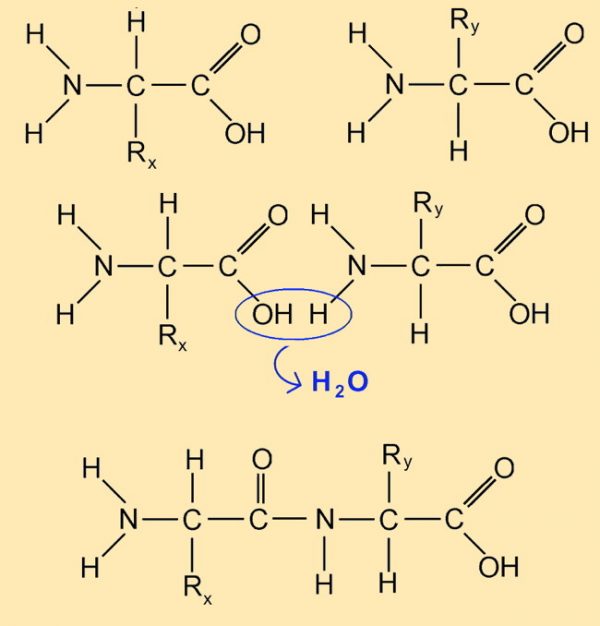
4.2.2 Atombindung – Kondensation und Hydrolyse
Die Abb. EA_4.2-2 a/b stellt den Vorgang der Kondensation am Beispiel der Aminosäuren dar. Aminosäuren sind die Bausteine der Proteine. Ein Blick auf die Struktur der Polysaccharide (siehe AB 1_2.1„Kohlenhydrate – etwas genauer betrachtet„), den Fettaufbau (siehe AB 1_2.2 „Fette – etwas genauer betrachtet„) oder die Verknüpfung von Aminosäuren zu Proteinen (siehe AB 1_2.3 „Proteine – etwas genauer betrachtet„) zeigt, dass an den entsprechenden Bindungsstellen immer die gleiche Art der Verknüpfung bzw. Trennung möglich ist. Nachfolgende Links in Form von Animationen helfen, diese Vorgänge besser zu verstehen. Sie sind in englischer Sprache – kein Problem!
|
|||
|
4.2.3 Ionen und Ionenbindung
Ion (griech. ἰόν „gehend“) Ein Ion ist ein elektrisch geladenes Atom oder Molekül. Atome oder Moleküle haben im neutralen Zustand genau so viele Elektronen wie Protonen. Eine elektrische Ladung entsteht – und damit das Ion – wenn ein Atom oder Molekül ein oder mehrere Elektronen weniger oder mehr als im Neutralzustand hat. Ionen sind bei Elektronenmangel positiv und bei Elektronenüberschuss negativ geladen. Ziel der Elektronenabgabe oder -aufnahme ist das Erreichen einer aufgefüllten Außenschale. Positiv geladene Ionen werden Kationen, negativ geladene Anionen genannt. verändert nach: http://de.wikipedia.org/wiki/Ion
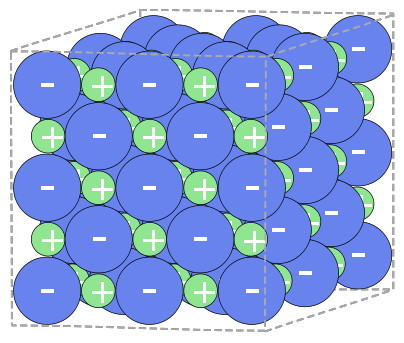
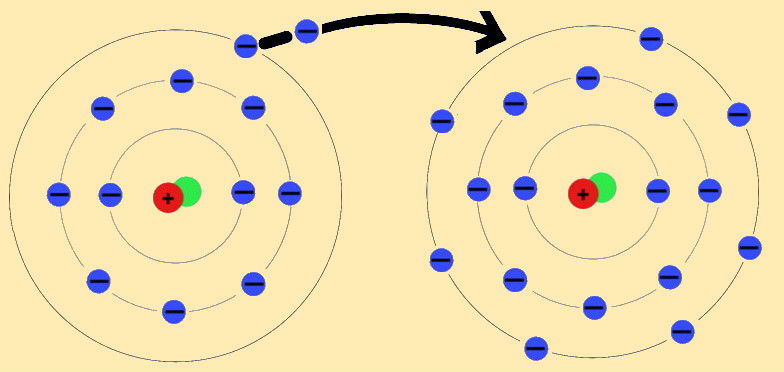
| Jeder kennt und nutzt Kochsalz oder Natriumchlorid (NaCl). Vor Millionen Jahren durch die Verdunstung von Meerwasser entstanden, liegt dieser Stoff als farbloser Kristall vor, aufgebaut aus Natrium- und Chlor-Ionen (Abb. EA_4.2-4).
Im menschlichen Körper spielen die enthaltenen Natrium-Ionen eine große Rolle, z.B. bei der Erregungsleitung an den Nerven. Chlorid-Ionen sind ein wesentlicher Bestandteil der Gewebsflüssigkeit und sind u.a. für osmotische Prozesse wichtig.Wie in der Abbildung zu erkennen, sind die Chlor-Ionen relativ groß und negativ geladen, die Natrium-Ionen kleiner und positiv geladen, in der Symbolschreibweise ausgedrückt: Cl– und Na+. Was ist hier geschehen? Betrachtet man die beiden Atome Natrium und Chlor (Abb. EA_4.2-5a,b), so fällt auf, dass sich auf der äußersten Schale (M-Schale) des Natrium-Atoms nur ein Elektron befindet. Dem Chlor-Atom fehlt dagegen auf der äußersten Schale (M-Schale) ein Elektron, um die um die angestrebte Anzahl von acht Valenzelektronen zu erreichen (siehe Edelgasregel / Abschnitt 4.2.1). Diese Regel wird erfüllt, wenn ein Elektron auf die äußerste Schale des Chlor-Atoms übertragen wird. Das Cl-Ion hat damit acht Valenzelektronen auf der M-Schale und das Na-Ion acht Valenzelektronen auf der L-Schale. Für beide Schalen ist die „angestrebte“ Kapazität vollständig. Im festen Zustand lagern sich diese beiden Ionen aufgrund ihrer elektrostatischen Anziehung zu einem geordneten Verband, auch Ionengitter genannt, zusammen. In Wasser wird das Ionengitter aufgelöst, die Ionen trennen sich voneinander (= Dissoziation) und liegen als freie Ionen vor. Es ist wichtig zu wissen, dass die entstandenen Ionen andere Eigenschaften haben, als die Ursprungsatome!
|
|||
|
|
4.2.4 Wasserstoffbrückenbindung
Die folgenden Ausführungen sind verkürzt und vereinfacht! Kenntnisse zu folgenden Inhalten sollten vorhanden sein: Atomaufbau, PSE, Atombindung und Darstellung der Lewis-/Valenzstrichformel. Eine Wasserstoffbrückenbindung findet man in der Biologie unter anderem in großen Molekülen (=Makromolekülen). Sie dient meistens der Ausbildung räumlicher Strukturen und/oder der Stabilisierung molekularer Strukturen und prägt damit auch deren Eigenschaften. Das ist z.B. der Fall bei der Bindung von zwei Nucleotiden der DNA zum Aufbau des DNA-Doppelstranges (Abb. EA_4.2-6) oder der Faltungen langer Aminosäureketten zur Ausbildung komplexer Proteinstrukturen (Abb. EA_4.2-7).
Eine einfache Definition der Wasserstoffbrückenbindung lautet:
Eine Wasserstoffbrückenbindung – auch kurz Wasserstoffbrücke oder H-Brücke -beruht auf einer Wechselwirkung in Form von Anziehungskräften zwischen dem in einem Molekül atomar gebundenen Wasserstoffatom (X−H) und dem freien Elektronenpaar eines Atoms, das in einem anderen Molekül (Y) atomar gebunden ist. X und Y müssen dabei eine hohe Elektronegativität aufweisen. (Erklärung „Elektronegativität“ siehe hier)
verändert nach: https://de.wikipedia.org/wiki/Wasserstoffbrückenbindung (Zugriff: 2015-05-12)
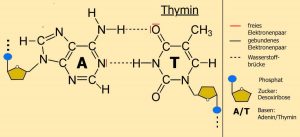
Betrachtet man nun eine der H-Brücken zwischen den Basen Adenin und Thymin so lässt sich diese folgendermaßen erklären:
| Im Adenin – dort in der NH2-Gruppe – ist das Wasserstoffatom mit einem Stickstoffatom verbunden, das eine höhere Elektronegativität als Wasserstoff besitzt. Dementsprechend wird das gemeinsame Elektronenpaar näher zum Stickstoffatom herangezogen, d.h. das Atom mit der niedrigeren Elektronegativität wird etwas positiver (δ+). Diese schwach positive Ladung wird mit δ+ (sprich: delta positiv) bezeichnet. Sie erhält kein „+“, weil es sich nicht um eine „volle“ positive Ladung, sondern nur um den „Hauch“ einer positiven Ladung handelt. Das Sauerstoffatom im gegenüberliegenden Thymin ist etwas elektronegativ. Es zieht damit die Bindungselektronen zwischen dem O und dem C ein Stückchen zu sich herüber und wird damit leicht negativ geladen (δ–). Außerdem besitzt es noch zwei Paar freie Elektronen, weil nur zwei der sechs Außenelektronen des Sauerstoffs für die Bindung mit dem Kohlenstoffatom benötigt werden (Hinweis: siehe unbedingt 3. Aufgabe!). Bildlich gesehen liegen sich nun ein etwas positiv und ein etwas negativ geladenes Atom gegenüber – der Spruch „Gegensätze ziehen sich an“ kommt zur Geltung. Zwischen beiden Seiten wirken nun Anziehungskräfte (= so genannte elektrostatische Kräfte), die zur gegenseitigen Anziehung und auch Ausrichtung dieser Molekülteile führen. Eine Wasserstoffbrücke ist entstanden, und zwar zwischen dem schwach positiv geladenen H und den freien Elektronenpaaren des Sauerstoffs.Wasserstoffbrückenbindungen können z.B. durch Hitze, aber auch durch Enzyme wieder gelöst werden. |
|
4.2.4 Van-der-Waals-Kräfte oder -Wechselwirkung
Bei den „Van-der-Waals-Kräften“ handelt es sich um zwischenmolekulare Kräfte, die zu einem Zusammenhalt zwischen Molekülen führen. Die dabei wirkenden Kräfte sind sehr schwach.
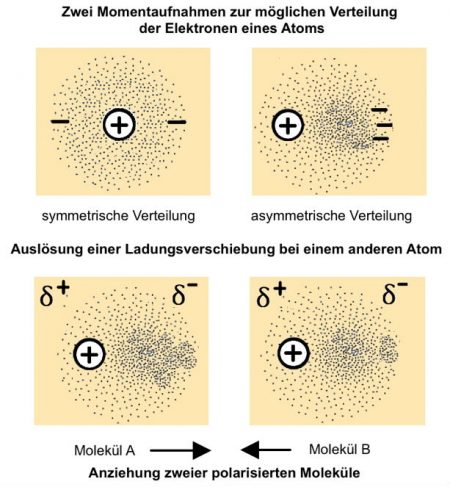
| Das Zustandekommen dieser Kräfte liegt darin, dass sich die Elektronen eines Atoms oder Moleküls zufällig für kurze Zeit in einem Bereich „anhäufen“ (= asymmetrische Verteilung). Dadurch ist dieser Bereich partiell (lat.: pars „Teil“) sehr schwach negativ geladen. Man spricht auch von einer partiellen negativen Ladung bzw. von einem negativ polarisierten Teil eines Atoms. In anderen Bereichen fehlen die Elektronen. Dort entsteht ebenfalls eine partiell positive Ladung. Man spricht dann von einem Dipol. Die Ladungen werden mit δ− (= sprich: Delta negativ) und δ+ gekennzeichnet (Abb. Abb. EA_4.2-9).
(δ: siehe auch Wasserstoffbrückenbindung) Die Ladungsverschiebung in einem Atom kann
Die dabei wirkenden Kräfte sind einerseits gering. Treten diese Erscheinungen andererseits jedoch häufig auf und sind die Oberflächen der beteiligten Moleküle relativ groß, können die entstehenden Kräfte sehr wirksam sein. Der folgende Link zeigt in vereinfachter Art und Weise, aber verständlich und nett das zuvor Gesagte.
|
|
Der „Gecko“ – ein Anwendungsbeispiel für die „Van-der-Waalssche-Wechselwirkung“
Geckos laufen kopfüber an der Decke oder senkrecht eine Glaswand hinauf. Sei benutzen dazu keinen „Kleber“, sondern ein Haftungssystem, das auf den „Van-der-Waalsschen-Kräften“ beruht. Auf jeder Oberfläche befindet sich eine Lage Wassermoleküle als hauchdünner Film. Elektronenmikrokopische Aufnahmen zeigen, dass die Gecko-Zehen aus Hunderttausenden feinen Keratin-Härchen aufgebaut sind. Jedes einzelne spaltet sich noch einmal in mehrere hundert Untereinheiten, sogenannte „Nanohärchen“ auf. Die Enden dieser Nanohärchen sind etwa 200nm (= 1/10 des menschlichen Haares) groß. Nur sie kommen in Kontakt mit der Lauffläche. Ausschließlich durch die Kräfte unterschiedlicher Ladungsverteilungen in den Molekülen am Ende der Nanohärchen und denen der Oberfläche kommt es zur Haftung der Geckofüße. In der modernen Nanotechnologie versucht man, diese Erkenntnisse zu nutzen. verkürzt nach: https://jacobs.physik.uni-saarland.de/home/index.php?page=forschung/home_cms_forschungdet25-1&navi=forschung (Zugriff: 2015-12-12) Der folgenden kurze Filme zeigen die Besonderheiten des Baus der Gecko-Zehen.
Weitere Informationen zum Gecko und Nanotechnologie finden sich u.a. hier:
|

Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung – Weitergabe unter gleichen Bedingungen 4.0 International Lizenz.