AB 1_2.2
Thema: Fette – etwas genauer betrachtet
zurück zur Übersicht: Arbeitsblätter (AB) Kapitel 2
Die Aussage „… etwas genauer“ soll deutlich machen, dass die Fette hier lediglich etwas tiefgehender als Stoffgruppe behandelt werden. Die folgenden Ausführungen können und sollen keinesfalls den Ansprüchen eines Chemieunterrichtes genügen! Es geht lediglich darum, Biologie-Interessierten etwas mehr Informationen zur Verfügung zu stellen.
Hinweis: Falls du Probleme hast, Aussagen und/oder Abbildungen auf den folgenden Seiten zu verstehen, hilft dir vielleicht der Exkurs A „Chemische Grundlagen – gar nicht so schwer“.
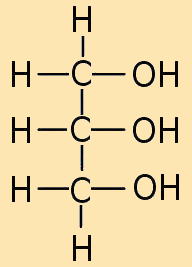
Alle Neutralfette oder Triglyceride bestehen aus zwei Komponenten: Einem Glycerinmolekül, das mit drei gleichen oder verschiedenen Fettsäuren verbunden ist.
Während das Glycerinmolekül immer gleich ist, unterscheiden sich die Fettsäuremoleküle voneinander durch ihre Kohlenwasserstoffketten und zwar bezüglich
Je nach Länge der Kohlenwasserstoffkette spricht man von* kurzkettigen (4 – 6 C-Atome), mittelkettigen (8 – 12 C-Atome) und langkettigen (14 – 24 C-Atome) Fettsäuren. In Nahrungsmitteln besitzen 95% der Fette Fettsäuren mit einer Kettenlänge von 12 bis 20 C-Atomen. Die Kettenlänge der Fettsäure hat folgende Auswirkungen:
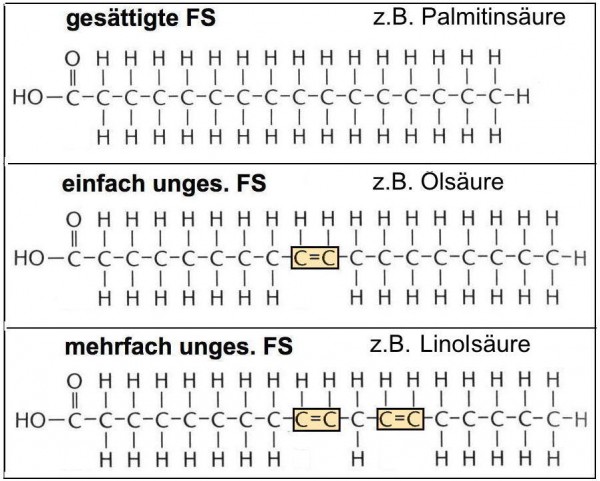
Die Anzahl von Doppelbindung im Fettsäuremolekül führt zu einer weiteren Unterscheidung dieser Molekülgruppe (Abb. AB 1_2.2-3). Gesättigte Fettsäuren enthalten keine Doppelbindung, d.h. jedes Kohlenstoffatom in der Kette ist mit Wasserstoffatomen gesättigt (jedes C Atom hat 2 H-Atome, das letzte in der Kette 3 H-Atome). Hauptvorkommen der gesättigten Fettsäuren sind tierische Fette, wie Sahne, Butter, Käse, Talg und Schmalz. Ausnahmen bilden die Öl- und Kokospalme, die ebenfalls einen hohen Gehalt an gesättigten Fettsäuren aufweisen. Ein Beispiel für eine gesättigte Fettsäure ist die Palmitinsäure (C16H32O2), die z.B. in Palmöl (bis zu 80%) und Schweineschmalz (bis zu 40%) vorkommt. Räumlich betrachtet, nehmen die gesättigten Fettsäuren wenig Raum ein, da sie wie „Streichhölzer“ dicht gepackt nebeneinander liegen. Schließlich haben Fette mit einem relativ hohen Anteil an gesättigten Fettsäuren einen höheren Schmelzbereich aufweisen. Beispiele dafür sind Kokosfett(ca. 90% gesättigte FS) oder Butter (ca. 50% gesättigte FS). Ungesättigte Fettsäuren enthalten eine oder mehrere Doppelbindungen zwischen den Kohlenstoffatomen, d.h. sie besitzen mindestens zwei nebeneinander stehende Kohlenstoffatome, die nicht vollständig mit Wasserstoffatomen gesättigt sind. Dieses bewirkt in der Struktur des Moleküls, dass die Fettsäure an dieser Stelle nicht gestreckt ist, sondern einen Knick von etwa 30o aufweist. Die Folge: Das Fettsäure- bzw. das Fettmolekül benötigt dadurch mehr Raum. Gleichzeitig nehmen damit die – wenn auch schwachen – Anziehungskräfte zwischen den Molekülen ab (siehe auch AB 9_2.2 „Fette im Alltag – verderben, braten, rauchen & Co.). Besitzt eine Fettsäure nur eine Doppelbindung, so spricht man von einer einfach ungesättigten Fettsäure. Ein Beispiel für eine einfach ungesättigte Fettsäure ist die in fast allen tierischen und pflanzlichen Ölen und Fetten vorkommende Ölsäure (C18H34O2), z.B. in Olivenöl (bis zu 70%), Rindertalg (bis zu 35%) und in High-Oleic-Sonnenblumenöl* (bis zu 90%). Zeigt die Fettsäure mehr als eine Doppelbindung, dann lautet die Bezeichnung mehrfach ungesättigte Fettsäure. |
|
Die Doppelbindungen bei einfach oder mehrfach ungesättigten Fettsäuren können Unterschiede bezüglich der räumlichen Anordnung (=Konfiguration) der Wasserstoffatome aufweisen. Befinden sie sich auf der gleichen Seite, so spricht man von eine cis-Konfiguration, stehen sie sich jedoch gegenüber, liegt einer trans-Konfiguration vor. Für Nichtchemiker klingt das nach „Kleinkram“, aber es hat bedeutsame Folgen im Stoffwechsel des Menschen. Wie man erkennt, verschwindet der „Knick“ im Molekül und damit die räumliche Anordung der Fettsäuremoleküle im Fett. Die ungesättigte Fettsäure wird damit quasi zur gesättigten Fettsäure. Der Fachbegriff für diese Gruppe ungesättigter Fettäuren, die mindestens eine trans-konfigurierte Doppelbindung enthalten, lautet Trans-Fettsäuren.
In der Natur werden ungesättigte Trans-Fettsäuren durch Mikroorganismen im Pansen der Wiederkäuer gebildet und finden sich dementsprechend auch in deren Körper wieder, d.h. die Milch und das Fett dieser Tiere enthalten davon einen Masseanteil von etwa 3-5 %.
Ansonsten entstehen diese Stoffe nur durch Prozesse in der Lebensmitteltechnologie. Dabei werden Öle durch sogenannte „Fetthärtung“ unter Verwendung von Hitze, Druck und einem Katalysator in einen festeren Zustand überführt. Das bekannteste und älteste Beispiel ist die Margarine, die aus Sonnenblumenöl hergestellt werden kann. Lebensmittel, die ebenfalls industriell erzeugte Trans-Fettsäuren enthalten, sind z.B. Fertigpizzen, Chips, Pommes Frites, Popcorn, Blätterteig und Croissants.
Der Gehalt an diesen industriell erzeugten Molekülen in Lebensmitteln ist zwar durch geänderte Produktionsverfahren in den vergangenen Jahren beträchtlich gesenkt worden (Margarine 1970 ca. 40% und 2014 ca. 1,5% Trans-Fettsäuren), dennoch wird die heutige Aufnahmemenge pro Tag in Deutschland durchaus kritisch diskutiert. In anderen Ländern gibt es Obergrenzen für den Gehalt an industriell erzeugten Trans-Fettsäuren in Lebensmitteln, in den USA, sind diese seit 2018 verboten.
Wichtig: Auch beim starken Erhitzen von Ölen und Fetten im Haushalt können diese gesundheitlich bedenklichen Stoffe entstehen.
Exkurs: Fettsäuren vereinfacht beschrieben dargestellt
Fettsäuren werden in der Regel nicht in der Ausführlichkeit dargestellt bzw. gekennzeichnet, wie z.B. in Abb. AB 1_2.2-3.
Im Folgenden werden verschiedene Möglichkeiten der Darstellung von Fettsäuren aufgeführt.
1. Darstellung c / vereinfachte Strukturformel
Palmitinsäure C16H32O2 CH(CH2)7COOH
Ölsäure C18H34O2 CH3(CH2)7CH=CH(CH2)7COOH
Linolsäure C18H32O2
CH3(CH2)4CH=CH-CH2-CH=CH(CH2)7COOH2. Darstellung mit Angabe der C-Atome, Anzahl und Lage der Doppelbindungen
Palmitinsäure 16:0
Ölsäure 18:1 cis-9 / (ω-9)
Linolsäure 18:2 cis-9, cis-12 / (ω-6)Erläuterungen:
Die Kohlenstoffatome im Fettsäuremolekül lassen sich auf zwei Arten durchnummerieren, ausgehend von der Carboxylgruppe (-COOH) oder vom anderen Ende aus, der sogenannten Methylgruppe (-CH3).
Normalerweise wird auf der Seite der Carboxylgruppe begonnen. Lediglich bei den ungesättigten Omega-n-Fettsäuren wird am anderen Kettenende begonnen, zu zählen. Das dort vorhandene Kohlenstoffatom wird immer als „ω“ („Omega“) – der letzte Buchstabe des griechischen Alphabets – bezeichnet.
Dementsprechend ist die Ölsäure eine Omega-9- und die Linolsäure eine Omega-6-Fettsäure.3. Grafisch vereinfachte Darstellung mit Anzahl der C-Atome, Lage und Art – cis oder trans – der Doppelbindung/en
Erläuterungen:
Elaidinsäure ist eine einfach ungesättigte Fettsäure mit einer trans-Konfiguration der Doppelbindung. Von der „Form“ und letztlich auch von der „Wirkung“ her entspricht diese Fettäure eher einer gesättigten Fettsäure. Sie kommt z.B. in Milch- und Rinderfett vor, tritt aber vor allem verstärkt bei der Fetthärtung auf. Die Ölsäure – eine Omega-9-Fettsäure – gleicht der Elaidinsäure in der Summenformel, besitzt aber eine cis-Konfiguration. Sie ist bis zu 80% in Olivenöl enthalten. Beide Moleküle betrachtet, kann man von Isomeren sprechen.Das Einzeichnen des „Knickes“ bei der Ölsäure ist nicht unbedingt erforderlich, weil man weiß, dass eine cis-Konfiguration immer mit dieser räumlichen Dimension verbunden ist.
Isomere (vereinfacht)
Bei Isomeren (griech.: iso „gleich“ / méros „Teil“) handelt es sich um Moleküle mit gleicher Summenformel, aber unterschiedlicher räumlicher Anordnung der Atome.
Zurück zum Begriff „Fett“, d.h. der gemeinsamen Betrachtung von Fettsäuren und Glycerin in Form von Ölen, halbweichen und festen Fetten.
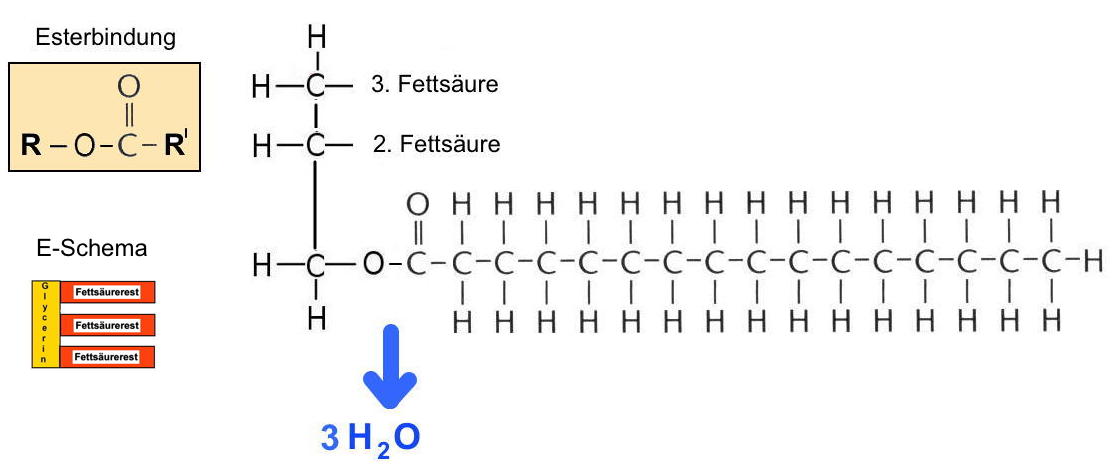
| Die Verbindung von Glycerin und drei gleichen oder ungleichen Fettsäuren (siehe Abb. AB 1_2.2-7) erfolgt auf dem Weg einer Kondensation, d.h. der Abspaltung von Wassermolekülen (siehe Exkurs A „Chemie gar nicht schwer“ Pkt. 4.2.2). Enzyme sind in der Lage, diese Reaktion durch Hydrolyse wieder rückgängig zu machen (siehe hier). Diese Art der Verknüpfung zwischen einem Alkohol und einer Säure unter Wasserabspaltung wird als „Esterbindung“ bezeichnet. Nach erfolgter Verknüpfung muss der Begriff „Fettsäure“ durch den Begriff „Fettsäurerest“ ersetzt werden. Das neu entstandene Molekül wird als Triglycerid oder Neutralfett bezeichnet. Es überwiegt der hydrophobe Teil, d.h. dieses Molekül ist nahezu unpolar. Das bedeutet, dass diese Moleküle weitestgehend wasserunlöslich sind, sie lagern sich in bzw. auf Wasser aneinander – so bilden sich z.B. „Fettaugen“ auf der Hühnersuppe. Die Wasserunlöslichkeit bedeutet aber auch, dass die Triglyceride keinen Einfluss auf osmotische Prozesse haben. |
Die folgenden Aufgaben können mithilfe der vorherigen Ausführungen bearbeitet werden.
| 1. Olivenöl enthält mehrere Fettsäuren. Die folgende Abbildung zeigt ein mögliches Triglycerid in diesem Öl. Analysiere die in diesem Triglycerid enthaltenen Fettsäuremoleküle.
a-Notiere ihre Summenformel und eine vereinfachte Strukturformel. Hilfen findest du hier: Darstellung von Fettsäuren. |
|||
2. Das folgende Diagramm befasst sich mit den Schmelzpunkten verschiedener Fettsäuren.
 Abb. AB 1_2.2-9 Schmelzpunkte verschiedener Fettsäuren a- Beschreibe das Diagramm. b- Leite aus den Daten des Diagrammes (Fettsäuren A – H) Regelhaftigkeiten ab und begründe diese fachlich. c- Vergleiche die Daten der letzten vier Fettsäuren (I – Elaidinsäure / J – Ölsäure / K Linolsäure/ L – Linolensäure) und begründe, warum sie nicht in die zuvor abgeleitete Regelhaftigkeit passen. |
|||
3. Begründe, warum manche Fettsäuren einen niedrigeren Schmelzpunkt aufweisen als andere.
|
|||
4. Stelle eine Vermutung auf, warum man bei Fettsäuren von einem „Schmelzpunkt“ spricht, bei Fetten jedoch von einem „Schmelzbereich“.
|
|||
Begründe, was man aufgrund der partiellen Polarität der sauerstoffhaltigen Gruppe der Triglyceride erwarten könnte, und warum dieses vor allem bei längeren Fettsäureresten nicht so ist.
|
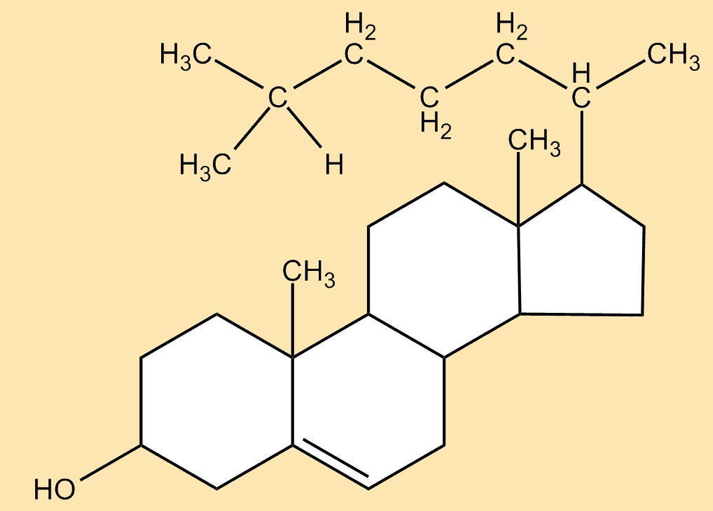
| Kein Fett, aber ein fettähnlicher Stoff ist Cholesterin. Von der Molekülstruktur her hat Cholesterin (griech.: cholé „Galle“ / stereós ‚fest‘) nur wenig gemeinsam mit den Fettsäuren bzw. Triglyceriden. Es gehört zur Gruppe der Steroide (griech.: stereós „fest“ / -oeidḗs „Ähnlichkeit“) und ist bei Tier und Mensch zu finden, nicht bei Pflanzen. Es wird aus drei sechseckigen und einem fünfeckigen Kohlenstoffring aufgebaut. Seine Gemeinsamkeit mit den Fetten besteht vor allem in seiner Wasserunlöslichkeit.Cholesterin wird entweder über die tierische Nahrung dem menschlichen Körper zugeführt – im Durchschnitt 300 bis 800 mg – oder vom Körper selbst über einen energieverbrauchenden komplexen Syntheseweg hergestellt. Hauptorte der Cholesterinproduktion sind die Leber – bis zu 700 mg täglich – und die Darmschleimhaut. Bei gesunden Menschen wird die Cholesterinproduktion des Körpers bei zu hoher Aufnahme von Cholesterin durch die Nahrung reduziert. Bei Aufnahme zu viel gesättigter Fettsäuren wird dieses Gleichgewicht gestört.Das Gehirn, das ohne Cholesterin nicht funktionsfähig ist, produziert sein eigenes Cholesterin, da dieser Stoff die Blut-Hirn-Schranke nicht passieren kann. Eine positive Bedeutung des Cholesterins für das Gehirn ist z.B. Gegenstand neurobiologischer Forschung (siehe folgende Links).
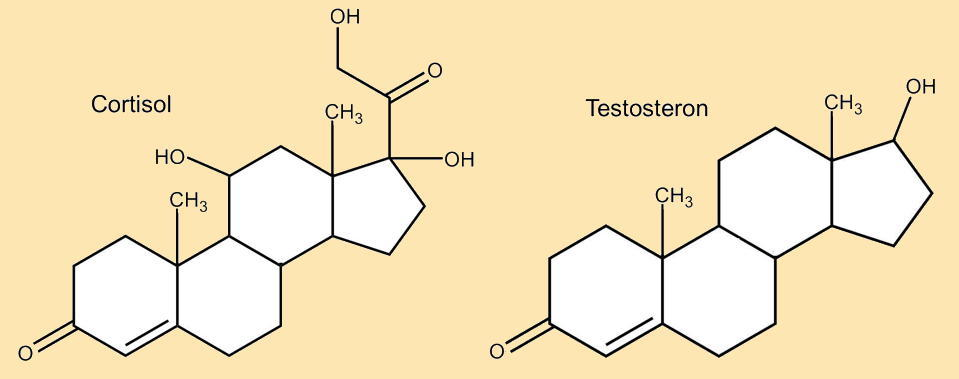
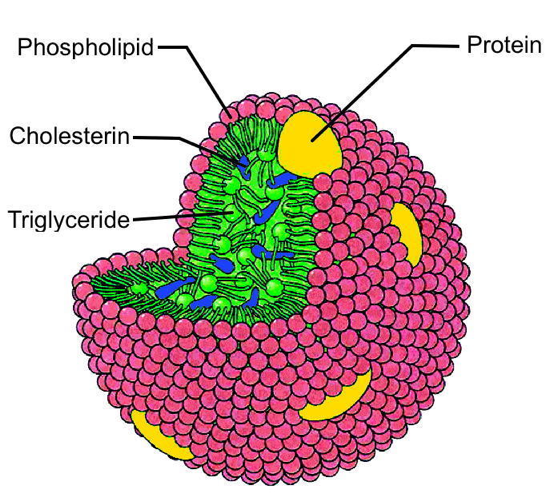
Weitere positive Aspekte des Cholesterins liegen in seiner Unverzichtbarkeit in allen Zellmembranen (siehe Kap.4.1) und darin, dass es Ausgangstoffe für andere lebensnotwendige Körperstoffe darstellt. Als Beispiele seien hier nur zwei wichtige Körperstoffe genannt: Cortisol und Testosteron. |
| 6. Benenne den Beleg dafür, dass Cholesterin Ausgangsstoff der beiden im Folgenden aufgeführten Stoffe (Abb. AB 1_2.2-11) ist. Informiere dich über die Funktion dieser beiden Stoffe im Buch oder im Internet. |
|
| 7. Cholesterin hat eine große Bedeutung in Zusammenhang mit der Struktur und Funktion der Zellmembran. Natürlich besitzen auch Pflanzen Zellmembranen, bei ihnen muss es einen „Ersatzstoff“ geben, die sogenannten Phytosterine.
Vergleiche sie mit dem Cholesterin und informiere dich über ihre Wirkung im menschlichen Körper. Dabei hilft dir u.a. folgender Link: |
|
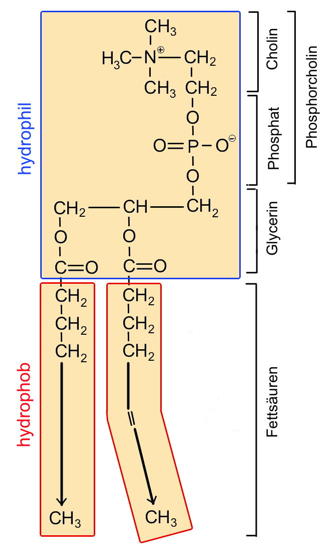
| 8. Stelle dir folgende Situationen vor: a-Du schüttest ein Glas voller Phospholipide auf eine Wasseroberfläche. b-Du schaffst es, mit einem starkem Rührgerät viele Phospholipide kurzzeitig unter die Wasseroberfläche zu bringen.Fertige für beide Situationen je eine Skizze an, die verdeutlicht, wie sich die Phospholipide räumlich auf dem Wasser bzw. im Wasser anordnen. Benutze für ein Phospholipidmolekül die rechts stehende Skizze.Was man aus der Anordnung der Phospholipide gelernt hat, findest du in AB 15_2.3 / Aufg.2. |
 |
| Lösung: |
Am Ende noch einige Anmerkungen zu Fett und „Energie“.
Der Energiegehalt von einem Gramm Fett beträgt etwa 9 kcal/g (37 kJ/g). Damit enthält ein Gramm Fett doppelt soviel Energie wie ein Gramm Kohlenhydrat oder Eiweiß.
Bereits im Magen werden Fette gewissermaßen vorverdaut. Im Dünndarm werden die Triglyceride durch Enzyme in frei Fettsäuren und Glycerin zerlegt. Beide werden vom Dünndarm aufgenommen,wieder in Triglyceriden umgewandelt und gelangen schließlich ins Blut. In den Zellen werden sie in den oxidativen Abbau eingeschleust und es erfolgt die Energiegewinnung in Form von ATP, dem „Treibstoff“ des Körpers. Genauere Informationen dazu finden sich im Kap. 5 „Verwertung der Nährstoffe„.
Der Bedarf an Fetten eines durchschnittlichen Erwachsenen liegt bei ca. 30 Prozent der aufgenommenen Energiemenge, das entspricht bei 2.000 kcal pro Tag der Aufnahme von 67 g Fetten. Dabei ist darauf hinzuweisen, dass diese Werte durchaus umstritten sind!
Der Fettspeicher, das sogenannte Depotfett, eines gesunden Erwachsenen umfasst etwa 10 -12 kg. Es reicht aus, um den Körper einen Monat lang mit Energie zu versorgen.
Es besteht ein Zusammenhang besteht zwischen Fetten und Kohlenhydraten, der auch in Hinblick auf die Ernährung von Bedeutung ist (siehe AB 1_2.1 „Kohlenhydrate – etwas genauer betrachtet“).

Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung – Weitergabe unter gleichen Bedingungen 4.0 International Lizenz.