AB 1_2.3
Thema: Proteine – etwas genauer betrachtet
zurück zur Übersicht: Arbeitsblätter (AB) Kapitel 2
Die Aussage „… etwas genauer“ soll deutlich machen, dass die Proteine hier lediglich etwas tiefgehender als Stoffgruppe behandelt werden. Die folgenden Ausführungen können und sollen keinesfalls den Ansprüchen eines Chemieunterrichtes genügen! Es geht lediglich darum, Biologie-Interessierten etwas mehr Informationen zur Verfügung zu stellen.
Hinweis: Falls du Probleme hast, Aussagen und/oder Abbildungen auf den folgenden Seiten zu verstehen, hilft dir vielleicht der Exkurs A „Chemische Grundlagen – gar nicht so schwer“.
Der Name „Eiweiß“ wird in der Literatur erstmals von dem Chemiker und Apotheker Caspar Neumann (1683-1737) als Bezeichnung für das Weiße des Hühnereies verwendet.
Der Begriff „Protein“ wurde 1838 von dem Mediziner und Chemiker Jöns Jacob Berzelius (1779 – 1848) erstmalig vorgeschlagen. Er leitete die Bezeichnung von dem Begriff „proteios“ (griech.: grundlegend / „erstrangig“) ab, da er davon ausging, dass alle Proteine aus einer gemeinsamen Grundsubstanz bestehen würden. Darüber entstand ein heftiger Streit unter den damaligen Wissenschaftlern – aber so ganz falsch waren seine Vorstellungen nicht.
Der niederländische Mediziner und Chemiker Geraldus Johannes Mulder (1802 – 1880) wird als der eigentliche Entdecker der Proteine angesehen. Er konnte 1836 erstmals nachweisen, dass Proteine aus den Elementen Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff aufgebaut sind. Die ersten Aminosäuren (Glycin, Leucin und Tyrosin) wurden ebenfalls in den ersten Jahrzehnten des 19. Jh. entdeckt.
Weitere Erkenntnisse blieben den Forschern allerdings aufgrund fehlender Analysemethoden verborgen bzw. mussten sehr spekulativ bleiben. Erst mit Beginn des 20.Jh. kam es zu einer intensiven Erforschung der Proteine.
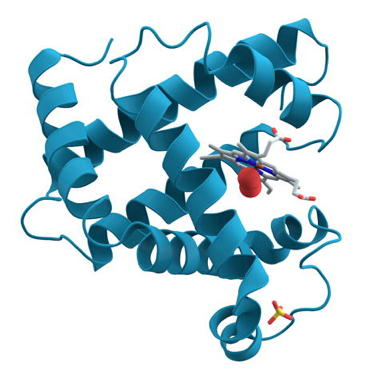
Die bedeutsamsten Methoden, um Proteine zu erforschen sind die Röntgenstrukturanalyse und die NMR (nuclear magnetic resonance) -Spektroskopie. Durch die Verwendung dieser und weiterer Methoden konnten bereits umfangreiche Proteindatenbanken erstellt werden.
Röntgenstrukturanalyse (vereinfacht)
Röntgenstrahlen sind aufgrund ihrer sehr kleinen Wellenlänge (ca. 0,1 nm) in der Lage, die Struktur von Proteinen bis zur atomaren Ebene darzustellen.
An den Atomen werden die Röntgenstrahlen gebeugt bzw. gestreut (= Änderung des Strahlenverlaufes durch das Auftreffen auf Hindernisse). Aus den dabei entstehenden Mustern kann auf die Elektronendichten und damit auf die Positionen einzelner Atome geschlossen werden. Voraussetzung für den Einsatz dieser leistungsfähigen Methode ist, dass die Proteine als Kristall vorliegen, denn nur in diesem Zustand sind die einzelnen Atome regelmäßig angeordnet.NMR-Spektroskopie (vereinfacht)
NMR-Spektroskopie kann die Strukturen von Proteinen in natürlicher Umgebung darstellen, d.h. die genaue Lage der Atome in einem Molekül kann ermittelt werden. Bei dieser Methode wird durch den Einsatz extrem starker Magnetfelder der Zustand des Atomkerns beeinflusst. Dabei wird Energie in Form von Strahlung frei. Deren Frequenz (= Anzahl der Wellenberge der Strahlung pro Zeiteinheit) ist einzigartig für jede Atomart und deren Umgebung. Auf diesem Weg kann die Molekülstruktur durch den Einsatz leistungsfähiger Computer errechnet werden.Genauere Informationen finden sich u.a. hier:
https://de.wikipedia.org/wiki/Kristallstrukturanalyse (Zugriff: 2016-07-12)
https://de.wikipedia.org/wiki/Kernspinresonanzspektroskopie (Zugriff: 2016-07-12)
https://de.wikipedia.org/wiki/Protein_Data_Bank (Zugriff: 2016-07-12)
Mit der Erforschung von Proteinen befassen sich heutzutage die unterschiedlichsten Wissenschaften. Chemiker, Biochemiker, Biophysiker und Genetiker erforschen schwerpunktmäßig die strukturellen und funktionellen Eigenschaften von Proteinen auf den Ebenen der Moleküle und der Zellen. Auch Immunologen und Endokrinologen (Endokrinologie = Wissenschaft von den Hormonen) betreiben Grundlagenforschung im Zusammenhang mit Proteinen. Ihre Blicke sind allerdings schon stark auf Vorgänge im Organismus ausgerichtet.
Ernährungswissenschaftler, Lebensmitteltechniker und Biotechnologen befassen sich mit den Proteinen als Nährstoff bzw. Nahrungsbestandteil. Dabei geht es sowohl um Proteinmengen, als auch um deren Zusammensetzung, deren Wechselwirkungen mit anderen Stoffen und schließlich um eine Proteinoptimierung.
Die besondere Bedeutung der Proteine liegt darin, dass
Damit verbunden ist die Tatsache, dass Proteine in jedem Organismus in einer ungeheuren Vielfalt vorkommen müssen, zumal sie nicht nur am Aufbau lebender Strukturen, sondern auch an allen Lebensprozessen beteiligt sind. |
|
| Bei Klick: Beispiele für die Vielfalt der Proteinfunktionen |
| Die Proteinbiosynthese (siehe AB 2_2.3 „Proteinbiosynthese – kurz und knapp“) ist Ausgangspunkt der Proteinentstehung. Den Ort, an dem dieser Prozess in der Zelle stattfindet nennt man Ribosomen. Entsprechend der genetischen Information werden dort bestimmte Aminosäuren zu mehr oder weniger langen Ketten miteinander verknüpft. Bei den am Aufbau der Proteine beteiligten Aminosäuren handelt es sich um lediglich 20 verschiedene Bausteine.
Dieser relativ kleinen Anzahl steht eine große Gruppe von Aminosäuren – mehr als 200 – im menschlichen Körper gegenüber, die nicht an der Bildung von Proteinen beteiligt ist. Diese nichtproteinogenen Aminosäuren entstehen z.B. durch enzymatisch bedingte Umwandlung aus proteinogenen Aminosäuren. Jede einzelne dieser Aminosäuren hat ihre eigene Bedeutung in den verschiedensten Stoffwechselprozessen.
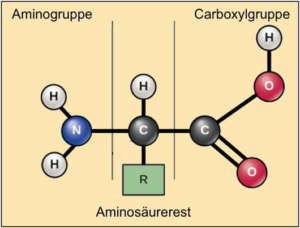
Alle für den Proteinaufbau relevanten Aminosäuren zeigen die gleiche Grundstruktur (Abb. AB 1_2.3-3). Vom sogenannten α*-C-Atom ausgehend unterscheidet man
* d.h., die beiden funktionellen Gruppen befinden sich am gleichen Kohlenstoffatom. Streng genommen müsste man deshalb immer von α-Aminosäuren sprechen. |
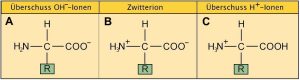
| Diese Abb. 1_2.3-3 vom Aminosäuremolekül ist einerseits richtig, andererseits entspricht sie nicht ganz dem Vorkommen von Aminosäuren in der Realität. Wird eine Aminosäure in Wasser gelöst, liegt sie hauptsächlich als Zwitterion (Abb. AB 1_2.3.-4 / B). In der Realität sind Aminosäuren allerdings in der Regel von einem sauren (= Überschuss der H+-Ionen) oder basischen Milieu (= Überschuss der OH–-Ionen) umgeben. Die Carboxylgruppe kann ihr H-Ion im basischen Milieu leicht abgeben und besitzt damit die Eigenschaft einer Säure (A). Die Aminogruppe mit ihrem N-Atom kann aufgrund eines freien Elektronenpaares in saurem Milieu leicht ein H+-Ion aufnehmen und besitzt damit die Eigenschaft einer Base (C). |
| Das zuvor Gesagte hat nichts damit zu tun, dass Aminosäuren u.a. als neutral, sauer oder basisch bezeichnet werden. Diese Attribute beziehen sich ausschließlich auf die Aminosäurereste (siehe Tab. AB 1_2.3-2 Aminosäurereste). |
Für den Aufbau eines Proteins stehen „nur“ 20 verschiedene Aminosäuren zur Verfügung. Auf den ersten Blick kann man sich kaum vorstellen, dass diese Anzahl ausreicht, so unendlich viele verschiedene Proteine aufzubauen. Eine einfache Rechnung macht deutlich, dass dieser Wert mehr als ausreichend ist: Würde ein Protein lediglich 10 AS-Bausteine enthalten, dann gäbe es bereits 2010 (=100.000.000.000.000.000.000) Möglichkeiten, wie dieses Protein hinsichtlich der Aminosäure-Reihenfolge (= Aminosäure-Sequenz) her aussehen könnte. Da die meisten Proteine aus Ketten von 100 – 500 Aminosäurebausteinen bestehen, muss die Vielfalt der sich daraus ergebenden Möglichkeiten wohl nicht weiter erläutert werden.
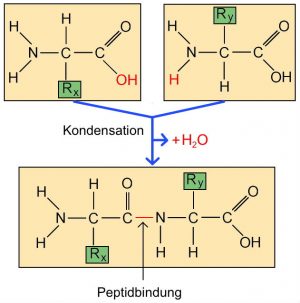
| Zur Bildung einer Aminosäurekette müssen die Aminosäuren miteinander verknüpft werden. Dieses geschieht am Ende der sogenannten Bioproteinsynthese (siehe AB 2_2.3 „Proteinbiosynthese – kurz und knapp“).Die Verbindung zweier Aminosäuren erfolgt zwischen der Amino- und der Carboxylgruppe. Bei diesem Vorgang wird ein Molekül Wasser freigesetzt. Die Art der Verknüpfung zwischen Aminosäuren wird als „Peptidbindung“ bezeichnet (Abb. AB 1_2.3-5). Der dabei stattfindende Vorgang wird Kondensation genannt. Eine Auflösung dieser Verbindung findet durch eine Hydrolyse statt, d.h. unter Zugabe eines Wassermoleküls.Ein Beispiel für die kettenartige Verknüpfung einiger Aminosäuren zeigt die Abbildung (AB 1_2.3-6). Diese Art der Anordnung von Aminosäuren wird „Primärstruktur“ genannt. |
|
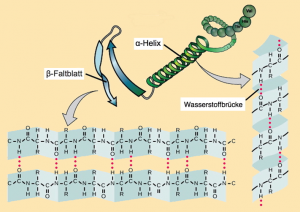
| Die unendlichen Kombinationsmöglichkeiten der Aminosäuren innerhalb der Primärstruktur müssten eigentlich ausreichen, um die vielfältigen Aufgaben der Proteine zu erfüllen. Aber wie sollen diese langen unhandlichen Ketten zu den Orten ihrer Aktivität in der Zelle, der Zellmembran bzw. anderen Strukturen des Körpers transportiert werden und wie sollen sie in dieser Form mit anderen Molekülen bzw. Molekülkomplexen zusammen reagieren? Es ist klar, das geht so nicht! Aus diesem Grund müssen weitere Schritte folgen, die schließlich zum einsatzfähigen Protein führen. Der nächste Schritt zum fertigen Protein besteht in der Ausbildung der sogenannten Sekundärstruktur. Dabei kommt es zur Bildung von Wasserstoffbrücken zwischen der Aminogruppe (N-H) und der Carboxylgruppe (C=O) von nicht benachbarten Aminosäuren in der Peptid-Kette. Das Ergebnis sind relativ stabile räumliche Gebilde, entweder eine α-Helix oder eine β-Faltblattstruktur. An einigen Stellen kann es auch bei einer kettenartigen Struktur bleiben (Abb. 1_2.3-7). Warum entsteht die eine oder andere Struktur? Es sind die jeweils vorkommenden Aminosäuren bzw. deren Reihenfolge (= Sequenz), die „entscheiden“, ob die eine oder andere Struktur entsteht oder nicht. Genauer soll hier nicht auf die damit verbundenen Bedingungen bzw. Prozesse eingegangen werden. |
|
| Die beiden folgenden Links versuchen die Ausbildung der Sekundärstrukturen (α- / β-Struktur) zu veranschaulichen. |
| https://www.youtube.com/watch=UWm3vt1mbcw&feature=youtu.be (Zugriff: 2016-07-06) https://www.youtube.com/watch?v=t6yUNXd8hio&feature=youtu.be (Zugriff: 2016-07-08) |
In einem weiteren Schritt wird eine dreidimensionale Struktur, die sogenannte Tertiärstruktur, gebildet.
Zu diesem Zweck ist es notwendig, sich etwas genauer mit den Aminosäuren zu befassen.
Wie unterscheiden sich die proteinogenen 20 Aminosäuren voneinander und welche Bedeutung haben diese Unterschiede aus biologischer Sicht, z.B. für die Ausbildung der Tertiärstruktur?
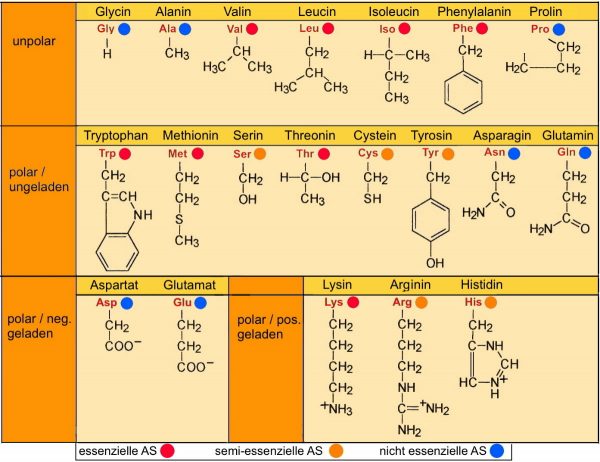
Bei Betrachtung der verschiedenen Aminosäurereste, fällt auf, dass sie sich sehr voneinander unterscheiden. Ihr Aufbau reicht vom einfachen Glycin, deren Rest nur aus einem Wasserstoffatom besteht, bis hin zu Resten mit mehreren funktionellen Gruppen. Einige sind unpolar, andere polar und wieder andere zeigen unterschiedliche Ladungen.
Wie zu sehen sein wird, ist ihre unterschiedliche Beschaffenheit entscheidend dafür verantwortlich, welche Raumstruktur das spätere fertige Protein einnimmt.
Die folgende Tabelle (Tab.2 AB 1_2.3) zeigt die verschiedenen Aminosäurereste.
Anmerkung: Die Begriffe „essenziell, semi-essenziell, nicht essenziell“ werden hier erklärt (Kap. 2.3 „Proteine – das sind fast Alleskönner„)
Die unterschiedlichen Eigenschaften bzw. Ausprägung der Aminosäuren ermöglichen den Zusammenhalt der Tertiärstruktur (Abb. 1_2.3-8 ) durch die Ausbildung von
- Wasserstoffbrücken zwischen polaren Aminosäureresten (Aminosäurerest = ASR),
- kovalenten Bindungen zwischen den ASR von Cystein und Methionin,
- Ionenbindungen zwischen geladenen ASR und
- hydrophoben Wechselwirkungen zwischen unpolaren ASR unter Beteiligung von van-der Waals-Kräften (siehe auch Exk. A).
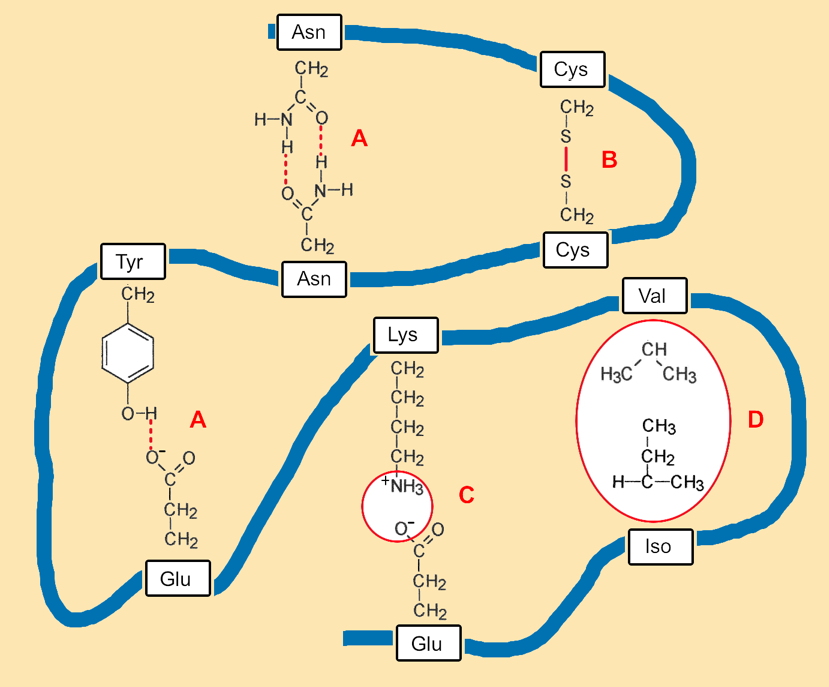
Abb. AB 1_2.3-8
Beispiele der Stabilisierung der Tertiärstruktur durch verschiedene Bindungsarten (vereinfachte modellartige Darstellung)
In diesen Zusammenhängen ist erwähnenswert, dass die unpolaren und hydrophoben AS aus dem Wasser verdrängt werden und damit vorrangig im Inneren der Proteine zu finden sind. Polare und hydrophile Aminosäuren fördern dagegen die Wasserlöslichkeit von Proteinen. Schließlich ermöglicht der Einbau kleiner Aminosäurereste die Ausbildung von kleineren räumlichen Strukturen und umgekehrt.
Hinweis zum Lesen der Abbildung:
– „blaues“ Band = vereinfachte Darstellung miteinander verbundener weiterer Aminosäuren
-„LYS“ usw. sind Abkürzungen für die Namen von Aminosäuren
– A = Wasserstoffbrückenbindung B = Disulfidbrücke C = Ionenbindung D = hydrophobe Bindung
| Im letzten Schritt erfolgt die Ausformung der Quartärstruktur. Bei ihrer Bildung werden mehrere gleiche oder ungleiche Proteinketten mit jeweils eigener Primär-, Sekundär- und Tertiärstruktur zu einer übergeordneten Funktionseinheit zusammengefügt. Die meisten Proteine des menschlichen Organismus sind aus zwei bis vier Untereinheiten zusammengesetzt. Nicht viel, wenn man zum Vergleich das Protein, das die Hülle des Tabakmosaikvirus bildet, betrachtet: Es wird von über 2.000 Untereinheiten gebildet.Übrigens sind für die Ausbildung der Sekundär-, Tertiär- und Quartärstruktur bis auf ganz wenige Ausnahmen keine Enzyme notwendig.
Vor allem Proteine, die eine Enzymfunktion erfüllen, verfügen über weitere Bausteine, die selbst kein Protein sind, sogenannte Co-Faktoren oder Coenzyme. |
| Abschließend soll noch auf eine Besonderheit bei Aminosäuren hingewiesen werden.
Alle Aminosäuren – mit Ausnahme von Glycin – kommen in zwei Formen vor. Man unterscheidet eine D-Form (von dextro, rechts), in der die Amino-Gruppe des α-C-Atoms in der Fischer-Projektion nach rechts, und eine L-Form (von levo, links), in der sie nach links zeigt. In den Proteinen höherer Lebewesen kommt in der Regel nur die L-Form vor. Die bis in die 90er Jahre des letzten Jahrtausends vorherrschende Meinung, dass die D-Form nur bei Bakterien und Pilzen auftritt hat sich als falsch erwiesen. Heute weiß man, dass auch bei höheren Lebewesen Proteine mit D-Aminosäuren vorkommen. Über ihre Rolle im Stoffwechsel ist inzwischen u.a. bekannt, dass einzelne von ihnen eine wichtige Rolle im Nervensystem spielen und vielleicht auch einige Krankheiten mit dieser Aminosäure-Form zu tun haben. Eine große Rolle spielt die D-Form in der pharmazeutischen Industrie. Verschiedene Antibiotika enthalten entsprechende Aminosäuren, was deren Wirksamkeit gegenüber Bakterien erhöht. Die neueste Forschung hat gezeigt, dass die D-Form u.a. auch im Bereich des Umweltschutzes und der Hygiene erfolgreich eingesetzt werden könnte. So löst z.B. D-Tyrosin bakterielle Biofilme (= Schicht von Mikroorganismen), die u.a. im Krankenhausumfeld eine Rolle spielen. |
D-Aminosäuren sind auch in vielen Lebensmitteln enthalten. Sie sind entweder deren natürliche Bestandteile oder entstehen im Rahmen der Lebensmittelverarbeitung, wenn damit z.B. Temperatur- oder pH-Wert-Änderungen verbunden sind. Über negative Auswirkungen von D-Aminosäuren in Lebensmitteln auf die Gesundheit ist nichts bekannt.
Folgende Links vermitteln weitere Informationen zu dieser Thematik.
| https://de.wikipedia.org/wiki/D-Aminosäuren (Zugriff: 2016-04-15) http://www.spektrum.de/news/eine-neue-waffe-gegen-biofilme/1030260 (Zugriff: 2016-04-15) http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2921573/ (Zugriff: 2016-04-15) |
Die Funktionsfähigkeit eines Proteins hängt letztlich von dessen räumlicher Struktur ab. Diese Strukturen können auch zerstört werden. Der damit verbundene Vorgang wird als Denaturierung bezeichnet.
Bei der Denaturierung (lat.: de / „von, herab“, natura / „Natur“, „den natürlichen Zustand nehmend“) von Proteinen tritt eine strukturelle Veränderung auf, die mit einem Verlust der Funktion der betroffenen Proteine verbunden ist, obgleich deren Primärstruktur unverändert bleibt. Die Denaturierung kann auf physikalische (Hitze, Druck, Strahlung) oder auf chemische Einflüsse (pH-Wert, org. Lösungsmittel, waschaktive Substanzen) zurückzuführen sein. Sie ist nur in wenigen Fällen rückgängig zu machen.
Bei der Denaturierung von Proteinen werden vor allem die relativ schwachen Wasserstoffbrückenbindungen aufgebrochen. Aber auch die etwas stabileren Disulfidbrücken können durch bestimmte Stoffe zerstört werden. Das Protein liegt dann in relativ offener Struktur vor. In wenigen Fällen ist eine Renaturierung „zerstörter“ Proteine möglich (siehe auch AB 6_2.3 „Proteine im Alltag – Geschmack, Fieber und Muskelkraft“).
Die folgende Animation zeigt vereinfacht die Denaturierung von Proteinen. Keine Angst vor englischer Sprache!
| http://highered.mheducation.com/sites/animation__protein_denaturation.html (Zugriff: 2016-04-15) |
Dass die Bildung funktionsfähiger Proteine ein äußerst komplizierter Vorgang ist, sollte deutlich geworden sein. Der Zusammenbau eines funktionsfähigen Autos ist im Vergleich dazu wirklich einfach. Trotzdem durchläuft jedes hergestellte Fahrzeug am Ende der Produktion eine umfassende Qualitätskontrolle, damit möglichst kein fehlerhaftes Fahrzeug in den Gebrauch kommt. Etwas Vergleichbares gibt es auch in den Zellen. Alle Proteine durchlaufen eine Qualitätskontrolle, denn – und das mag etwas überraschen – Untersuchungen weisen darauf hin, dass etwa 30% aller Proteine fehlerhaft sind und durch Proteasen (= Enzyme, die Proteine in ihre Bestandteile spalten) sehr schnell wieder abgebaut werden. Neben einer fehlerhaften Erbinformation können auch andere Faktoren zu einem defekten Protein führen, dem bestimmte Abschnitte fehlen und/oder das Fehler in der räumlichen Struktur (= Faltungsfehler) aufweist.
Funktioniert diese Qualitätskontrolle nicht im ausreichenden Maße oder entstehen zu viele fehlerhafte Proteine, kann es zu Zellschädigungen bzw. auch Krankheitserscheinungen kommen (siehe auch AB 7_2.3 „Wenn es im Proteinhaushalt nicht stimmt“).
Über diese etwas komplizierten Vorgänge der Qualitätskontrolle bei Proteinen berichten u.a. folgende Links.
| https://de.wikipedia.org/wiki/Proteinqualitätskontrolle (Zugriff: 2016-04-05) https://de.wikipedia.org/wiki/Proteinfehlfaltungserkrankung (Zugriff: 2016-04-05) |
|
|
|
|
||
|
||
| Lösung zu Aufg.4: |
Abschließend einige Anmerkung zu Proteinen und Energie.
Der Energiegehalt von einem Gramm Protein beträgt etwa 4 kcal/g (17 kJ/g). Damit enthalten Proteine genauso viel Energie wie die Kohlenhydrate. Sie spielen jedoch im Vergleich zu Kohlenhydraten und Fetten eine absolut untergeordnete Rolle bei der Energieversorgung des Körpers. Proteine bzw. die Aminosäuren sollten auch nicht zur Energieversorgung genutzt werden, denn ihre Hauptaufgabe ist die Versorgung des Körpers mit „Baustoffen“. Darauf weist auch ihre nur sehr begrenzte Speicherfähigkeit hin (siehe Kap. 2.3). Nur in Extremsituationen, d.h. vor allem einer Mangelsituation an Kohlenhydraten bei großen Belastungen, z.B. einem Marathonlauf, zieht der Körper auch Aminosäuren zur Energiegewinnung heran. Eine länger andauernde Energiegewinnung aus Aminosäuren würde dem Körper schaden, da diese Bausteine eigentlich an anderen Stellen im Zellstoffwechsel benötigt werden.
Die mit der Nahrung aufgenommenen Proteine werden in Magen und Dünndarm durch Enzyme gespalten und aus dem Verdauungstrakt in das Blut überführt. Zur Energiegewinnung können Proteine über bestimmte Stoffwechselwege aus Leber und Muskeln in den oxidativen Abbau überführt werden. Dort erfolgt die Energiegewinnung in Form von ATP. Genauere Informationen dazu finden sich im Kap. 5 „Verwertung der Nährstoffe„.
Insbesondere in Hinblick auf Proteine ist der tägliche Bedarf zur Zeit sehr umstritten. Vor allem bei diesem Nährstoff scheint die Individualität (Geschlecht, Alter, Aktivität etc.) eine besonders große Rolle zu spielen. Auf jeden Fall sollte die aufgenommene Stickstoffmenge immer der ausgeschiedenen Stickstoffmenge entsprechen (siehe auch Kap.2.3).

Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung – Weitergabe unter gleichen Bedingungen 4.0 International Lizenz.