Exkurs – B / Teil-1
Enzyme – ohne sie geht gar nichts!
-
- Teil-1
- 1. Vorbemerkungen
- 2. Geschichte der (Bio-) Katalysatoren
- 3. Enzymstrukturen und ihre Aufgaben
- 4. Besondere Eigenschaften (= Spezifitäten) von Enzymen
- Teil-2
- 5. Regulation der Enzymaktivität
- 6. Enzyme in jedem Lebensbereich
Aus dem Blickwinkel dieses Projektes sind die Enzyme zunächst für die Abbauvorgänge im Rahmen der Verdauung (Kap. 3) zuständig. Sie machen damit die Nahrungsbestandteile für unsere Lebensprozesse verfügbar. Anschließend sind sie dann daran beteiligt, mit Hilfe der aus den Nahrungsbestandteilen gewonnenen Energie und Stoffen wieder neue lebensnotwendige Bestandteile für den Körperbau und den Stoffwechsel herzustellen (siehe auch AB 2_1 „Stoffwechsel – was ist das?“). Aber auch bei fast allen anderen Vorgängen im Körper bzw. in den Zellen sind Enzyme unverzichtbar. Darüber hinaus darf nicht übersehen werden, dass Enzyme in Zusammenhang mit unendlich vielen Sachverhalten eine entscheidende Rolle spielen, z.B. in der Textil-, Leder- und Papierindustrie, als Bestandteil vieler Reinigungsmittel, bei der Gewinnung von Biotreibstoffen, beim Einsatz verschiedener Methoden der Gen- und Biotechnologie, bei medizinischen Diagnose- und Therapieverfahren und sogar beim Kompostieren von Gartenabfällen. |
|
Die entscheidende Eigenschaft bzw. Fähigkeit aller Enzyme lässt sich durch die folgende Definition beschreiben.
Enzyme (griech.: enzymos „gesäuert“) sind fast immer Proteine, die in den Organismen als „Beschleuniger“ (= Katalysatoren) an fast allen chemischen Prozessen beteiligt sind. Ohne ihre Leistungen würden diese Reaktionen im Organismus so langsam ablaufen, dass die Existenz von Leben unmöglich wäre.
Was sich alles hinter dieser recht einfach erscheinenden Definition verbirgt, wird Thema der folgenden Abschnitte sein.
Die Anzahl der enzymatisch beeinflussten Abläufe, die sich in jeder Sekunde in den Zellen unseres Körpers abspielen, ist zu groß, um sie in einem Zahlenwert auszudrücken. Ungefähr 7.000 Enzyme des Menschen sind bezüglich ihres Aufbaus und ihrer Funktion erforscht. Viele weitere Tausend gilt es aber noch zu enträtseln.
Ein Enzym kann seine Arbeit für kurze oder auch für längere Zeit leisten, bevor es unwirksam wird. Letztlich müssen aber alle Enzyme immer wieder ersetzt werden.
Der Nachschub von Enzymen erfolgt ausschließlich über die Nahrung. Allerdings nicht als „Ganzes“! Der Proteinbestandteil der aufgenommenen Enzyme wird – wie alle anderen (Nahrungs-)Proteine auch – im Magen-Darm-Trakt verdaut. Die am Ende dieses Prozesses vorliegenden Aminosäuren werden nach der Aufnahme ins Blut bzw. in die Zellen wieder zum Aufbau von Proteinen bzw. neuen Enzymen im Rahmen der Proteinbiosynthese verwendet. Enzyme können dementsprechend auch nicht gespeichert, sondern immer „nur neu nachgeliefert“ werden.
Eine Ausnahme stellen Medikamente oder Nahrungsergänzungsmittel dar, die Enzyme in magensaftresistenter „Verpackung“ enthalten und diese so im intakten Zustand bis in den Dünndarmbereich transportieren. Über die Darmwand gelangen sie zum Teil – meistens allerdings nur in Bruchstücken – ins Blut und können dann im Stoffwechsel eine bestimmte Wirkung entfalten.
Schließlich sei noch angemerkt, dass es keine „lebenden“ oder „toten“ Enzyme gibt, denn ein Enzym ist kein Lebewesen, sondern ein Molekül! Mit dieser Begriffswahl wird gelegentlich vorgetäuscht, dass nur rohe Nahrung wertvolle Enzyme liefern kann, gekochte und gar gebratene Nahrung dagegen nicht.
In den folgenden Abschnitten wird versucht, den Aufbau und die Leistungen der Enzyme verständlich und sachbezogen darzustellen. Für eine mögliche Vertiefung von Inhalten wird auf entsprechende Links verwiesen.
Nach Klick findest du eine Info-Kurzfassung zu den Proteinen. |
||
|
2. Geschichte der (Bio-) Katalysatoren
Die Selbstverständlichkeit, mit der wir heutzutage über Enzyme reden und diese in vielen Lebensbereichen nutzen, besteht noch gar nicht so lange. Die folgende Tabelle veranschaulicht den Weg über das Wissen von Enzymen, ausgehend vom Altertum bis in die Neuzeit.
| Altertum bis Anfang 18. Jh. | Ohne es zu wissen, nutzten Menschen Enzyme schon vor ca. 4.000 Jahren, indem sie aus verschiedenen Pflanzen alkoholhaltige Getränke brauten oder aus Milch verschiedene Produkte herstellten. Auch bei der Anwendung von Pflanzenteilen bzw. ihrer Inhaltsstoffe zur Behandlung von z.B. Verdauungsproblemen (Papaya) oder Wunden (Ananas) kamen Enzyme zum Einsatz. Nicht selten vermuteten die Menschen hinter den in diesen Zusammenhängen beobachtbaren Vorgängen geheimnisvolle oder gar göttliche Kräfte |
|
| 1737 | Lange ging man davon aus, dass die Nahrung im Magen durch dessen Bewegungen, die man schließlich spüren konnte, mechanisch zerkleinert werde. Der Naturforscher R.F. Réaumur konnte bei Raubvögeln erstmals durch die Betrachtung von Mageninhalt zeigen, dass es „ein Auflösungsmittel sein muss “, das diese Arbeit übernimmt. |
|
| 1810 | Der russische Chemiker G. S. Kirchhoff (s.u.) fand zufällig heraus, dass sich Stärke durch das Kochen mit verdünnter Säure in Zucker „umwandelte“, ohne dass dabei die Säure verbraucht wurde – unerklärlich für damalige Zeiten. | |
| Fast zur gleichen Zeit machte der Chemiker H. Davy grundsätzlich ähnliche Beobachtungen. Er wunderte sich, dass Reaktionen verschiedener Dämpfe bei Anwesenheit von Platindrähten schon bei Zimmertemperatur stattfanden und dass das Platin selbst dabei anscheinend keine Rolle spielte. | ||
| 1823 | Für den Naturforscher J.B. Döbereiner war diese Beobachtung die entscheidende Grundlage für die Entwicklung des sogenannten „Platinfeuerzeuges“. Es war das erste Feuerzeug überhaupt und wurde bis Ende des 19. Jh. hergestellt. | |
| 1826 | Nach – aus unserer heutigen Sicht – etwas seltsamen Untersuchungen kam auch der amerikanische Militärarzt W. Beaumont zu dem Ergebnis, dass bestimmte Stoffe im Magen die Nahrung verarbeiten (siehe Kasten unten) . | |
| 1830 | Der französische Chemiker A. Payen entdeckte eine Substanz, die in der Lage war, Stärke in Glucose umzuwandeln. Er nannte sie „Diastase“ (griech.: diástasis „Entfernung“). Dabei handelte es sich um das Enzym, das heute als „Amylase“ bezeichnet wird. Es wurden immer mehr Substanzen gefunden, die grundsätzlich ähnliche bzw. vergleichbare Fähigkeiten zeigten. Für sie alle wurde der Begriff „Ferment“ (lat.: fermentum „Gärung, Sauerteig“) benutzt. |
|
| 1834 | L. J. Thenard konnte zeigen, dass Organe und Gewebe die Fähigkeit besitzen, Wasserstoffperoxid in Wasser und Sauerstoff zu zerlegen. Warum und wie, konnte er nicht verstehen. | |
| 1835 | Für die Beobachtung, dass ein Hilfsstoff sich bei einer Reaktion nicht verändert, führte der Chemiker J. Berzelius den Begriff „Katalyse“ (griech.: katálysis „Auflösung“) ein. Welche Kräfte damit verbunden sind, war ihm völlig unklar. | |
| 1836 | Dem Anatom T. Schwann gelang es, das erste tierische Enzym, das Pepsin, zu isolieren. Der Physiologe F.H. Bidder konnte nachweisen, dass zur Aktivität des Pepsins eine sehr saure Umgebung notwendig ist. | |
| 1878 | Der Physiologe W. Kühne führte den Begriff „Enzym“ ein und verdrängte damit zunehmend das Wort Ferment. | |
| 1894 | Der Chemiker E. Fischer entdeckte im Rahmen der Arbeiten über die enzymatische Verwertung von Zuckern, dass deren Umwandlung nur gelang, wenn das Substrat Zucker bezüglich seiner molekularen Struktur zu einem spezifischen Enzym passt. In seiner Veröffentlichung aus dem Jahre 1894 „Einfluss der Configuration auf die Wirkung der Enzyme“ machte er u.a. folgende Aussage: „Um ein Bild zu gebrauchen, will ich sagen, daß Enzym und Glucosid wie Schlüssel und Schloß zu einander passen müssen, um eine chemische Wirkung auf einander ausüben zu können.“ (aus: S. Neufeldt, Chronologie Chemie: Entdecker und Entdeckungen, Ausgabe 3 John Wiley & Sons 2016).
Damit prägte er den Begriff „Schlüssel-Schloss-Prinzip“. |
|
| 1898 | Der Chemiker E. Buchner (s.u.) konnte experimentell nachweisen, dass Enzyme auch außerhalb der Zellen aktiv sind. Er gab einen zellfreien Hefesaft zu Zucker und sah zu seinem Erstaunen, dass ein Gärungsprozess einsetzte. Damit war die Meinung von L. Pasteur aus der Mitte des 19. Jh. widerlegt, dass Gärung nur funktionieren könne, wenn für den Gärungsprozess Hefezellen – also etwas Lebendiges – vorhanden wären. |
|
| 1912 | Die energetischen Vorgänge bei der Leistung der Enzyme erforschte vor allem der Biochemiker und Arzt L. Michaelis. Das von ihm entwickelte Modell beschreibt die Abhängigkeit der Geschwindigkeit einer enzymatischen Reaktion von der Konzentration des umzusetzenden Substrats. | |
| 1930 | Beide Biochemiker, J.H. Northrop und W.M. Stanley, wiesen nach, dass der Hauptbestandteil eines Enzyms, u.a. Pepsin, ein Protein ist. Für ihre Arbeiten erhielten sie 1946 den Chemie-Nobelpreis. | |
| nach 1930 | In Zusammenhang mit den weiter verbesserten Möglichkeiten der Proteinaufklärung, verbunden mit der Entwicklung immer leistungsfähiger experimenteller Gerätschaften (Chromatografie, Spektroskopie, Röntgenstrukturanalyse, etc.) begann in den 50er Jahren die rasante Entwicklung der Enzymtechnologie. Sie ist Grundlage der Gentechnologie und vieler biotechnologischer Verfahren, die oft spezifisch „geschneiderte“ Enzyme benötigen. Ihre Anwendungsbereiche sind vor allem die technische Chemie, Pharmazie, Medizin und die Lebensmittelindustrie.
Vor allem in Bezug auf den zuletzt genannten Bereich wird darüber diskutiert, ob und inwieweit die klassischen Anwendungen von Enzymen durch Verfahren aus der Gen- und Biotechnologie ergänzt bzw. ersetzt werden können und dürfen. |
Das folgende Beispiel vermittelt einen Eindruck darüber, wie Naturwissenschaftler und Ärzte Anfang des 19.Jh. – auch im Bereich der Enzymforschung – gearbeitet haben.
Aus unserer heutigen Sicht erscheint uns dabei manches nicht nur seltsam, sondern auch komisch.
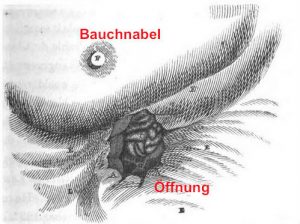
| Im Sommer 1822 wurde der verletzter Trapper A. St. Martin zu dem Wundarzt Dr. William Beaumont gebracht. Aus Versehen hatte sich ein Schuss aus einer Schrotflinte, geladen mit Pulver und Hühnerschrot, gelöst. Im Bauch des jungen Soldaten befand sich ein Loch. W. Beaumont reinigte und versorgte die Wunde, hatte aber kaum Hoffnung, dass A. St. Martin überleben würde. In der damaligen Zeit verlief ein Bauchschuss fast immer tödlich. Beaumont sollte sich jedoch täuschen. A. St. Martin überlebte unerwartet, aber die Wunde heilte nicht vollständig aus. Es blieb eine Öffnung, die in Verbindung mit dem ebenfalls beschädigten Magen stand. Alles was A. St. Martin zu essen bekam, verließ den Körper wieder über die Öffnung. W. Beaumont verhinderte dieses zunächst mit starken Verbänden. Im Laufe der Zeit wuchs aus dem umgebenden Gewebe an der Öffnung eine Art „Klappe“, die sich öffnen ließ. Das erste was W. Beaumont auffiel, war das Herausfließen von Flüssigkeiten nach der Nahrungszufuhr, wenn er mit den Fingern die Klappe aufdrückte. St. Martin lebte ab 1825 zunächst wieder für zwei Jahre bei seiner Familie. Er kam 1827 zu W. Beaumont zurück, der begeistert feststellte, dass die zu öffnende Klappe über dem Magen noch immer vorhanden war. |
|
| Er bezahlte A. St. Martin in den folgenden Jahren dafür, dass er täglich(!) seinen Mageninhalt untersuchen durfte. Unter anderem führte er mehrfach ein Stück rohes Fleisch – an einem Faden befestigt – über die Öffnung in den Magen ein. Als er den Faden wieder herauszog, war das Fleisch entweder stark verändert oder ganz verschwunden. Im nächsten Schritt führte er einen Schlauch in den Magen ein und entnahm damit die Magenflüssigkeit. Diese wurde dann von ihm für weitere Untersuchungen genutzt. Er stellte dabei u.a. fest, dass je nach Nahrungsmittel die Veränderungen durch die Magenflüssigkeit sehr unterschiedlich waren. So wurde z.B. Fisch viel schneller zersetzt als rohes Fleisch und alkoholische Getränke zeigten eine negative Einflussnahme auf die Wirkung der Magensäure im Vergleich zu Wasser, etc. Auf der Grundlage einer Vielzahl von genau protokollierten Untersuchungen veröffentliche W. Beaumont seine Beobachtungen und Schlussfolgerungen. Sein Buch (s.u.) fand auch in Europa bei anderen Naturforschern und Ärzten große Beachtung. Viele kamen, um vor allem sein „Untersuchungsobjekt“ A. St. Martin zu sehen. Manche boten sogar viel Geld, um ihn für eigene Untersuchungen zu nutzen. Im Jahr 1834 hatte A. St. Martin genug von den täglichen Untersuchungen, kehrte zu seiner Familie zurück und starb dort 1880. Mehrere Ärzte wollten der Familie den Leichnam abkaufen, um ihn genauer zu untersuchen. Die Familie lehnte ab.nach: Beaumont W. Experiments and Observations on the Gastric Juice, and the Physiology of Digestion, Maclachlan & Stewart, 1838 |
|
| In den Originalquellen zu G. S. Kirchhoff, W. Beaumont und E. Buchner zu lesen ist interessant und macht auch Spaß – es war eben eine ganz andere Zeit!
Die folgende Quelle führt zu einem Originalartikel von G.S. Kirchhoff über die Stärkeumwandlung aus dem Jahr 1811: Das von W. Beaumont verfasste Buch ist in deutscher Übersetzung aus dem Jahr 1834 in der „Bayerischen Staatsbibliothek / digital“ einsehbar: Originalinformationen zu den Hefeversuche von E. Buchner von 1898 finden sich hier: Schwerpunktquellen für die hier aufgeführten Informationen waren folgende Seiten: |
-
Enzymstrukturen und ihre Aufgaben
Katalysator / Enzym / Enzym-Substrat-Komplex / Schlüssel-Schloss-Prinzip / Cofaktoren
Bei der Beschäftigung mit Enzymen hat man leicht das Gefühl, von Begriffen erschlagen zu werden. Zum Verständnis der Leistungen von Enzymen sind gewisse Kenntnisse zu diesen Begriffen allerdings unverzichtbar.
Im Folgenden wird versucht, die Bedeutung der wichtigsten Fachbegriffe so einfach wie möglich und anhand von Beispielen zu erläutern
Katalysator (griech.: katá „ herab, völlig“ lysis „Auflösung“) / Katalyse
Ein Katalysator besteht aus Elementen oder Verbindungen und beschleunigt die Geschwindigkeit einer Reaktion. Mit der Geschwindigkeit ist die Menge der Moleküle gemeint, die pro Sekunde chemisch verändert werden. Nach Ablauf der Reaktion liegt der Katalysator unverändert bzw. unverbraucht vor. Eine Katalyse beschreibt den Ablauf einer stattfindenden Reaktion mit Hilfe eines Katalysators.
Im Rahmen einer Katalyse sind immer drei Bestandteile zu finden: Ein Ausgangsstoff (A), der Katalysator (K), der eine katalytische Reaktion bewirkt und ein aus der Reaktion hervorgehendes bzw. mehrere hervorgehende Produkte (P). Der Begriff Katalysator wird vorrangig in der Technik und in Zusammenhang mit anorganischen Stoffen benutzt.
| Beispiel:
Der Abgaskatalysator in Kraftfahrzeugen ist gewissermaßen die Schnittstelle zwischen Motor und Umwelt. Er dient dazu, gesundheitsschädliche Abgase in weniger schädliche Stoffe umzuwandeln. Die damit verbundenen Reaktionen würden auch ohne Katalysator ablaufen, allerdings sehr viel langsamer. Die Folge wäre, dass ohne ihn große Mengen schädlicher Stoffe in die Umwelt gelangen würden. Genauere Informationen zum Autokatalysator findet man z.B. hier: |
Diese synonymen Begriffe beziehen sich auf Katalysatoren in Zusammenhang mit Lebensprozessen. Im Folgenden wird nur noch der Begriff „Enzym“ (griech.: en “in“ / zýmē „Sauerteig“) verwendet.
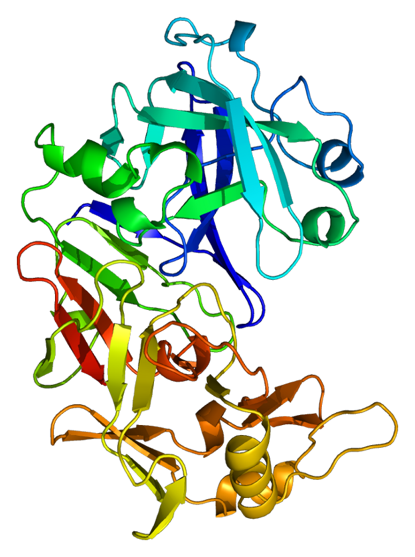
Der Hauptbestandteil eines Enzyms ist immer ein Protein, also ein organischer Stoff. Proteine sind aus Aminosäureketten zusammengesetzte Moleküle (siehe AB 1_2.3 / Kap.2.3).
Enzyme enthalten in ihrer Bezeichnung sehr oft die Endung –ase.
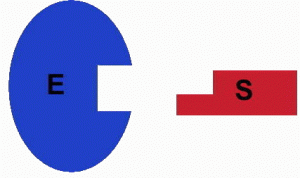
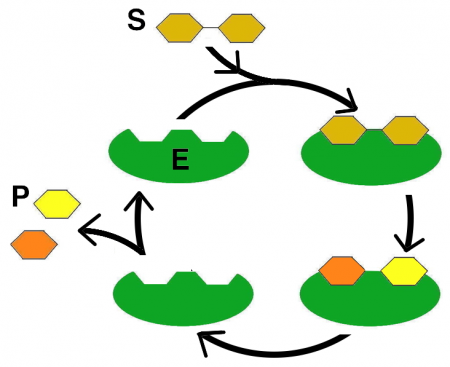
Das Substrat (S) ist diejenige Verbindung, die durch das Enzym (E) verändert werden kann. Zu diesem Zweck kommt es zu einer Verbindung zwischen Enzym und Substrat. Die Kräfte, die dabei eine Rolle spielen, sind die Wasserstoffbrückenbindung, die Van-der Waals-Kräfte oder kovalente Bindungen (siehe Exk. A).
Die Verbindung ist jedoch nur an einer bestimmten Stelle des Enzyms möglich, dem aktiven Zentrum (Synonym: Substratbindungsstelle).
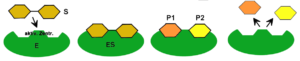
Kommt diese vorübergehende Verbindung des Enzyms mit dem Substrat zustande, dann nennt man das Gebilde aus Substrat und Enzym Enzym-Substrat-Komplex (ES). Das Substrat kann nun chemisch umgewandelt werden. Verantwortlich dafür sind Moleküle, die sich in der Nähe des aktiven Zentrums auf der Seite des Enzyms befinden.
Allgemein betrachtet besteht die stattfindende Enzymreaktion darin, dass einerseits im Substrat bestimmte Bindungen gelöst und andererseits wieder neue geknüpft werden. Am Ende dieses Prozesses ist ein neues Produkt (P) entstanden / sind mehrere neue Produkte entstanden.
Durch weitere am aktiven Zentrum ablaufende Reaktionen löst/lösen sich das/die entstandene/n Produkt/e wieder vom Enzym.
In den Abb. EB_3-3 ist ein solcher Vorgang dargestellt.
Es gibt aber auch Enzyme, die zwei Substrate zu einem einzigen neuen Produkt-Molekül miteinander verbinden.
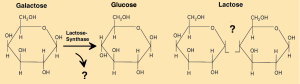
Lactose oder auch Milchzucker (siehe auch AB 1_2.1) ist in Milch und -produkten sowie in der Muttermilch enthalten. Im Rahmen der Verdauung wird im Dünndarm das Enzym „Lactase“ produziert, welches Lactose mittels Hydrolyse (= Spaltung durch Reaktion mit Wasser) in Glucose und Galactose aufspaltet. Über die Darmwand gelangen beide Produkte ins Blut und schließlich in die Zellen (siehe auch AB 5_2.1 „Probleme mit Milch und Milchprodukten“).
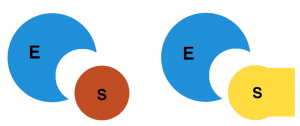
Schlüssel-Schloss-Prinzip / Induced-Fit-Modell
Die Vereinigung von Substrat und aktivem Zentrum gelingt nur, wenn beide so zueinander passen, wie nur ein bestimmter Schlüssel in das dazugehörige Schloss passt (= Schlüssel-Schloss-Prinzip). Das heißt, dass Teile der räumlichen Struktur des Substratmoleküls ein entsprechendes Negativabbild am aktiven Zentrum des Enzyms vorfinden müssen. Dessen räumliche Ausprägung ist vor allem auf die Tertiärstruktur des Enzym-Proteins zurückzuführen (siehe AB 1_2.3). Teilweise ähneln diese Strukturen „Taschen“ oder sogar „Tunneln“.
Liegt ein räumlich passendes aktives Zentrum vor, kann sich das Substrat mit dem Enzym verbinden. Die Reaktion/en zwischen Substrat und Enzym kann/können ablaufen.
In anderen Fällen liegt kein von vornherein „fertiges“ aktives Zentrum vor. Bei Annäherung des Substrats an das zugehörige Enzym kommt es zu einer Wechselwirkung zwischen beiden Bestandteilen. Erst jetzt erfolgt die Ausbildung eines passenden aktiven Zentrums. Dieses wird auch als „induzierte (= auslösende) Anpassung“ bezeichnet. Dementsprechend wird von dem „Induced-Fit-Modell“ gesprochen.
Die beiden folgenden Abbildungen verdeutlichen den Unterschied zwischen beiden Theorien in Form von Animationen. Bitte jeweils anklicken.
Bei den Cofaktoren kann es sich um eine organische Verbindung, ein Metallatom oder beides handeln, die den Proteinbestandteil des Enzyms ergänzen.
Cofaktoren lassen sich in zwei Kategorien unterteilen: Prosthetische Gruppe oder Coenzym.
Cofaktor: Prosthetische Gruppe
Bei dem Cofaktor handelt es sich um eine prosthetische Gruppe (griech.: prósthetos “hinzugefügt“), wenn dieses Molekül bzw. dieser Molekülkomplex dauerhaft und kovalent mit dem Proteinbestandteil des Enzyms verbunden ist.
Beispiel:
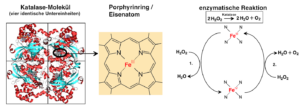
Katalase ist eines der wichtigsten Schutzenzyme in Zellen. In jeder Zelle entsteht als Nebenprodukt Wasserstoffperoxid (H2O2). Dieser Stoff ist ein Zellgift und muss deshalb schnell abgebaut werden. Ein Katalase-Molekül kann in der Sekunde(!) bis zu 4.000.000 Wasserstoffperoxid-Moleküle spalten (siehe auch hier), wobei Wasser und Sauerstoff entstehen.
Die Katalase des Menschen (Abb. EB_3-7) besteht aus vier identischen Untereinheiten zu jeweils 526 Aminosäuren. Im jedem aktiven Zentrum befindet sich ein sogenannter Porphyrinring. Diese organische Struktur findet man in vielen Enzymen mit Cofaktoren. In der Mitte dieses Ringes ist ein Eisenatom (Fe) eingebunden. Unter seiner Mitwirkung findet die Reaktion des Wasserstoffperoxids mit der Katalase statt.
Die folgende Abbildung zeigt vereinfacht die Leistung der Katalase beim Abbau des Wasserstoffperoxids.
*Was sich hinter den sogenannten „Oxidationszahlen“ des Eisens III bzw. IV verbirgt, musst du dazu nicht unbedingt verstehen. Für die reine Beschreibung reicht die Aussage, dass sich das Eisenatom verändert. Bist du jedoch daran interessiert, etwas Genaueres über Oxidationszahlen zu erfahren, musst du in einem Chemiebuch oder im Internet nachschauen.
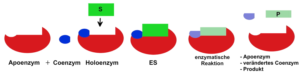
Cofaktor: Coenzym
Der Cofaktor ist ein Coenzym, wenn dieser Molekülkomplex nur sehr lose und zeitweise mit dem Proteinbestandteil des Enzyms verbunden ist. Außerdem kann das Coenzym im Rahmen der Enzymaktivität ebenso wie das Substrat verändert werden. Deshalb wird das Coenzym in diesem Zusammenhang auch als Cosubstrat bezeichnet.
Oft können unterschiedliche Enzyme das gleiche Coenzym – manchmal geringfügig verändert – nutzen. Viele Coenzyme leiten sich von Vitaminen ab und manche besitzen auch ein Metallatom.
Der Proteinbestandteil des Enzyms wird in diesem Fall als Apoenzym (griech.: apo „ab, weg“) bezeichnet. Zusammen mit dem Coenzym bildet er das sogenannte Holoenzym (griech.: holo „voll“).
Beispiel:
NAD (Nicotinamidadenindinukleotid) ist ein wichtiges Coenzym im Stoffwechsel. Den entscheidenden Baustein für das NAD liefert das Vitamin B3 (neuere Bezeichnung: Nicotinsäure oder Niacin / siehe Kap. 2.4). Niacin wird dem Körper in erster Linie über die Nahrung zugeführt.
NAD tritt in zwei Formen auf: NAD+ (= oxidierte Form) und NADH+H+ (= reduzierte Form). Soll Wasserstoff (H2) auf ein anderes Molekül übertragen werden, so tritt dieses Coenzym in Aktion (siehe z.B. Kap.5.1 / Atmungskette).
Die folgende Abbildung zeigt diesen Vorgang.
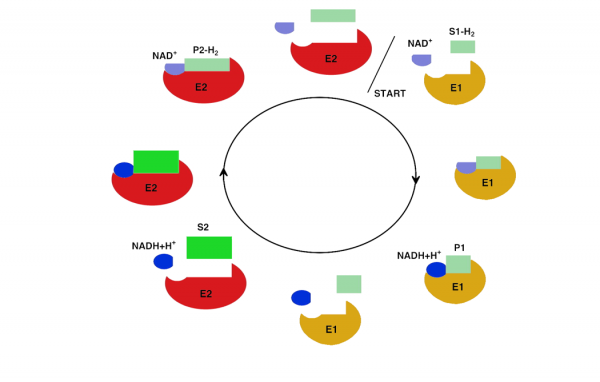
Abb. EB_3-9 Übertragung von Wasserstoff durch das Coenzym NAD
(E1- Reduktase E2- Oxidase S- Substrat P- Produkt)
Substratspezifität / Wirkungsspezifität / Erniedrigung d. Aktivierungsenergie / Unveränderbarkeit / Kurzlebigkeit
Die Besonderheiten von Enzymen sind in vielen Fällen eng mit ihrem Aufbau bzw. ihrer Struktur verbunden. Um die folgenden Ausführungen zu verstehen, ist es sinnvoll, die in Abschnitt 3 dargestellten Inhalte im Blick zu haben.
Substratspezifität
Streng genommen besagt die Substratspezifität, dass ein Enzym nur ein bestimmtes Molekül „verarbeiten“ kann (siehe auch V EB_2).
Die Ursache für die Substratspezifität liegt vor allem in der räumlichen Ausbildung des Proteinteils des Enzyms. Damit verbunden ist ein Bereich im Enzym, der nur mit dem einen Substrat in Verbindung treten kann. Es kommt zur Ausbildung des Substrat-Enzym-Komplexes (ESK, Schlüssel-Schloss-Prinzip, Induced-Fit-Theorie).
Der Nutzen dieser Substratspezifität liegt in der Notwendigkeit, an bestimmten Orten des Körpers unter bestimmten Bedingungen ganz bestimmte Substrate zu verarbeiten bzw. bestimmte Produkte zu erzeugen, um die Lebensfähigkeit des Organismus zu gewährleisten.
Mehrere Beispiele für die Substratspezifität von Enzymen sind bereits zuvor genannt worden (α-Amylase, Lactase, Katalase).
Die Substratspezifität soll deshalb hier unter einer besonderen Fragestellung behandelt werden:
Was passiert eigentlich, wenn für ein Substrat gar kein Enzym zur Verfügung steht?
Beispiel:
Zur Beantwortung dieser Frage soll an dieser Stelle ausnahmsweise nicht der Mensch im Vordergrund stehen, sondern Hund und Katze.
| Kakao bzw. die Bohnen des Kakaobaumes enthalten einen organischen Stoff mit dem Namen „Theobromin“. Er gehört zu einer Gruppe von Stoffen, die im Rahmen des Evolutionsprozesses in einigen Pflanzen als Fraßschutz ausgebildet worden sind. Theobromin befindet sich auch in allen Genuss- und Nahrungsmitteln, die unter Verwendung von Kakao hergestellt werden, z.B. Schokolade. Während der menschliche Organismus in der Lage ist, diesen Stoff enzymatisch abzubauen, funktioniert dieses bei Hunden und Katzen nicht. Dazu fehlt ihnen das entsprechende Enzym. Wenn Hunde oder Katzen z.B. Schokolade fressen, kann dieses für sie katastrophale Folgen haben und eventuell sogar zum Tode führen. Der Grund liegt darin, dass der Stoff Theobromin Einfluss auf das Herz-Kreislaufsystem hat. Es kommt u.a. zu Erhöhung des Herzschlages und des Blutdrucks. Wird Theobromin nicht abgebaut – wie es beim Menschen der Fall ist – wirkt dieser Stoff bei Hunden und Katzen wie ein Gift: Es kommt zu Krampfanfällen, Zittern oder sogar zum Atemstillstand. Es gilt also diesbezüglich darauf zu achten, dass Hunde und Katzen entsprechenden Genuss- bzw. Nahrungsmittel nicht fressen. Natürlich gilt auch hier, dass schwere Folgen nur in Zusammenhang mit einer entsprechenden Dosis zu erwarten sind – aber das muss man ja nicht ausprobieren! |
|
| Weitere Informationen dazu finden sich u.a. hier: http://www.vetmedblog.de/archives/13-Wie-genau-ist-das-nun-mit-Hund-und-Schokolade.html (2017-09-10) https://de.wikipedia.org/wiki/Theobrominvergiftung (2017-09-10) |
|
|
| Lösung zu Aufg. 5:
Hunde und Katzen sind reine Fleischfresser, die anderen genannten Tiere sind Pflanzenfresser. Theobromin ist in Pflanzen enthalten. |
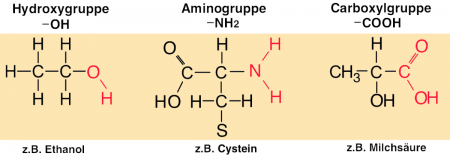
Allerdings sind viele Enzyme gar nicht zu 100% substratspezifisch. Das ist darauf zurückzuführen, dass Enzyme fast nie das ganze Substrat im aktiven Zentrum binden, sondern nur Teile davon. Häufig können unterschiedliche Substrate, die jedoch hinsichtlich der Bindungsstelle fast identische chemische Strukturen aufweisen, an das aktive Zentrum eines spezifischen Enzyms binden.
Die dann stattfindende Katalyse führt jedoch zu einem anderen Produkt und verläuft eventuell auch in einer anderen Geschwindigkeit ab.
In diesen Fällen spricht man von einer Gruppenspezifität der Enzyme.
Bei den gleichen chemischen Strukturen handelt es sich oft um sogenannte funktionelle Gruppen.
|
|
|
| Lösungen zu Aufg. 6 u. 7:
|
Wirkungsspezifität
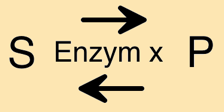
Jedes Enzym verändert das gebundene Substrat in eigener Art und Weise. Das bedeutet, dass das Enzym X sein Substrat immer auf dieselbe Weise verändert. Das Enzym Y bindet dasselbe Substrat, verändert es aber anders. Diese Besonderheit der Enzyme wird als Wirkungsspezifität bezeichnet (siehe auch V EB_2).
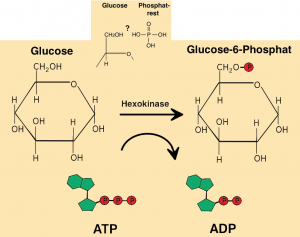
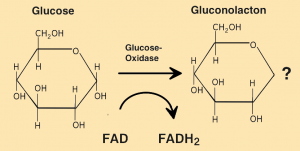
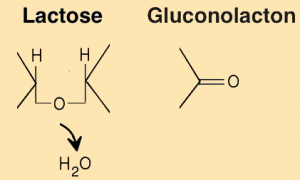
Dieses wird im Folgenden an drei Beispielen verdeutlicht, bei denen das Substrat Glucose je nach Enzym unterschiedlich verändert wird.
Beispiele:
Lösung zu den Aufg. 10a/b:
|
Auch wenn jedes Enzym in der Regel nur eine ganz bestimmte Wirkung am Substrat auslöst, so gibt es doch viele Enzyme, die grundsätzlich die gleiche chemische Reaktion herbeiführen. Die jeweiligen Enzyme werden zu einer Enzymklasse zusammengefasst. Insgesamt sind sechs Reaktions-/Enzymklassen bekannt.
Ausführlichere Informationen zu den Enzymklassen findet man hier:
| https://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/start.html (Zugriff: 2025-05.10) http://www.chemie.de/lexikon/EC-Nummer.html (Zugriff: 2017-09-12) http://flexikon.doccheck.com/de/EC-Klassifikation (Zugriff: 2017-09-12) |
In Zusammenhang mit der Wirkungsspezifität liest man in verschiedenen Quellen folgende Aussage: „Enzyme sind auch zur Rückreaktion fähig“.
Dieser Satz ist äußerst missverständlich, da er den Eindruck erweckt, dass z.B. das Enzym Lactase, das Lactose in Galactose und Glucose spaltet, aufgrund dieser Fähigkeit auch Lactose in den Milchdrüsen aus Galactose und Glucose aufbauen könne. Das trifft nicht zu, wie zuvor gezeigt wurde (siehe Abb. EB_4-4).
Grundsätzlich ist Folgendes dazu anzumerken:
Erniedrigung der Aktivierungsenergie
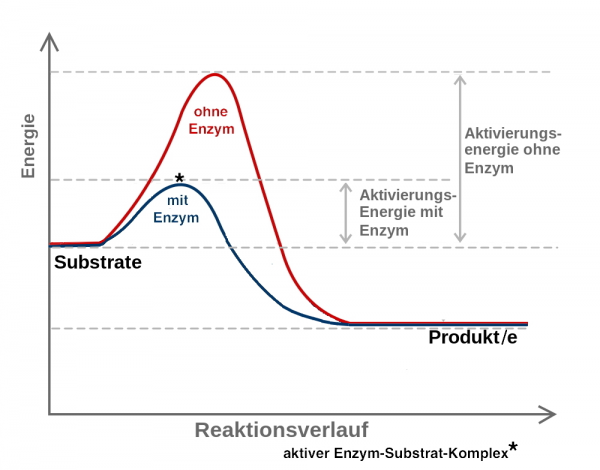
Viele chemische Reaktionen starten nicht von alleine. Sie benötigen Energie, d.h. es muss Arbeit geleistet werden.
Die Energie, die erforderlich ist, damit eine Reaktion abläuft, wird als Aktivierungsenergie bezeichnet. Sie trägt dazu bei, eine gewisse Reaktionsträgheit von Molekülen zu überwinden.
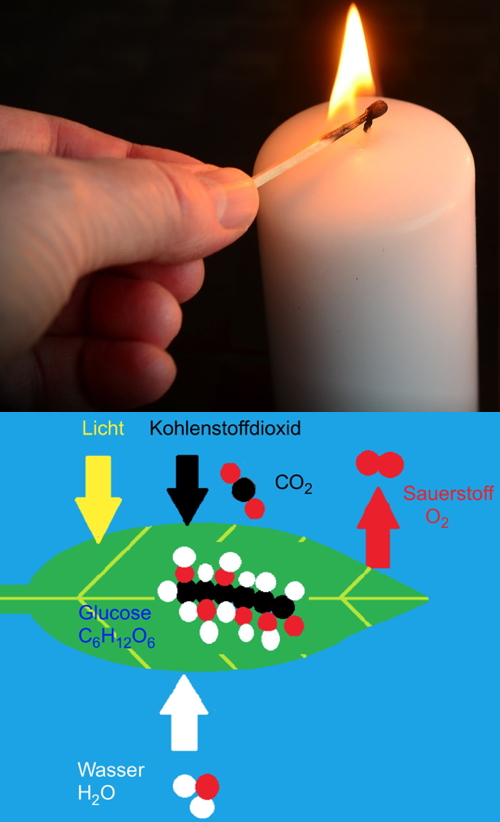
| Was ist die „Aktivierungsenergie“?
Dazu zwei Beispiele: Das Wachs im Docht einer Kerze brennt nicht von alleine, sondern erst nachdem man die hohe Temperatur einer Zündflamme ( = Wärmeenergie) eingesetzt hat. Für das Auslösen von chemischen Reaktion bzw. Stoffwechselprozessen sollen und können jedoch in unserem Körper weder hohe Temperaturen, noch Licht einwirken! Was bedeutet „Erniedrigung der Aktivierungsenergie“? Dazu das folgende Beispiel: Auffällig ist, dass das auf der linken Seite stehende, energiereiche Molekül (C6H12O6) in zwei relativ energiearme Stoffe umgewandelt wird. Was ist mit der in der Glucose enthaltenen Energie passiert? |
In der Zelle darf eine derartige Situation nicht auftreten, denn das dort eingeschleuste Glucosemolekül muss sofort und schnellstens die enthaltene Energie für den Organismus liefern.
Hier kommen nun die Enzyme ins Spiel.
Die Glucose bildet mit einem spezifischen Enzym ein Enzym-Substrat-Komplex und steht damit am Anfang einer langen Kette von vielen enzymatisch bewirkten Reaktionsschritten. Am Ende dieser Kette erfolgt die Gewinnung von ATP.
In Zusammenhang mit jedem einzelnen Reaktionsschritt ermöglicht ein spezifisches Enzym, dass eine eigentlich nicht bzw. extrem langsam ablaufende Reaktion doch stattfindet. Das heißt, dass pro Zeiteinheit jeweils viele Substrat-Moleküle zu dem gewünschten Produkt umgewandelt werden. Diese Fähigkeit von Enzymen wird als „Erniedrigung der Aktivierungsenergie“ bezeichnet. Zu Recht wird in Zusammenhang auch der Ausdruck „Beschleunigung der Reaktion“ verwendet.
Durch den Einsatz der Enzyme kann die Zelle also schnell und gezielt die im Bonbon enthaltene Glucose bzw. ihre Energie nutzbar machen.
Dieses wird verallgemeinernd in folgender Art und Weise dargestellt (Abb EB_4-7).
Natürlich muss auch im Rahmen der Arbeit eines Enzyms zunächst ein gewisser Energiebetrag aufgewendet werden, damit die beteiligten Moleküle miteinander reagieren.
Bleibt die Frage: Wer oder was bewirkt die Erniedrigung der Aktivierungsenergie, d.h. den „teilweisen Abbau des Berges bzw. die Verringerung der Trägheit des Substrat- Moleküls“?
Für eine fachlich vollständige Antwort auf diese Frage müsste man die Grundlagen zum Begriff „Energieumsatz“ bearbeiten. Darauf wird hier verzichtet und auf mögliche Einstiegsstellen zur Auseinandersetzung mit dieser Thematik hingewiesen (siehe weiter unten).
Dementsprechend können die folgenden Ausführungen bestenfalls nur einen kleinen, unvollständigen und vereinfachten Beitrag zur Beantwortung dieser Frage liefern:
- Es muss sichergestellt sein, dass das Ausgangprodukt überhaupt mit einem bzw. dem gewünschten Reaktionspartner zusammentrifft.
⇒Das wäre leicht dem Zufall überlassen, wenn das Enzym nicht beide zusammenbringen würde! - Bestimmte Atomgruppen möglicher Reaktionspartner müssen für einen schnellen und gewünschten Reaktionsablauf räumlich zueinander ausgerichtet sein.
⇒Dieses ermöglicht das Enzym mit Hilfe des aktiven Zentrums. - Das „Zusammenkommen“ beider Reaktionspartner sollte keinen zusätzlichen Energieverbrauch mit sich bringen.
⇒Die Bindung des Substrates am aktiven Zentrum erfolgt fast immer mit Hilfe energiesparender Wege, z.B. Wasserstoffbrückenbindungen oder Van-der-Waals-Kräften (siehe Exk. A).
| http://www.chemie.de/lexikon/Aktivierungsenergie.html (Zugriff: 2017-09-03) http://www.chemie.de/lexikon/Gibbs-Energie.html (Zugriff: 2017-09-03) https://hoffmeister.it/chemiebuch/reaktionskinetik (Zugriff: 2022-10-15) http://www.chemgapedia.de/kinetik/enzyme/ablauf_1.vscml.html (Zugriff: 2017-09-03) http://www.chemgapedia.de/michaelis_menten_gleichung.vlu.html (Zugriff: 2017-09-03) |
| http://www.cengage.com/biology/discipline_content/animations/enzyme_role_m.html (engl.) (Zugriff: 2017-09-03) |
„Der Hochsprungsportler überspringt die Latte, wenn er genug Energie dazu hat. Hat er diese nicht, scheitert er.
|
Unveränderbarkeit eines Enzyms
| Eine weitere Besonderheit von Enzymen ist die Tatsache, dass sie unverändert aus der abgelaufenen Reaktion hervorgehen und sofort für eine weitere Reaktion zur Verfügung stehen. Das heißt, sie sind in einem Kreislauf eingebunden (V EB_2).
Trotzdem sind Enzyme nicht „unsterblich“. Die Lebensdauer von Enzymen liegt zwischen einigen Stunden und mehreren Tagen.
|
|
|
Kurzlebigkeit des Enzym-Substrat Komplexes
Bei der Arbeit der Enzyme handelt es sich um chemische Reaktionen. Das heißt, dass aus bestimmten Ausgangsstoffen neue Stoffe, die Produkte, entstehen.
Wie lange sich im Rahmen einer Reaktion Stoffe miteinander verbinden, lässt sich nicht genau bzw. verallgemeinernd sagen.
Für Enzyme gilt allerdings, dass sie nur eine sehr kurze Zeit Kontakt mit dem Substrat haben bzw. mit den entstandenen Produkten halten.
Wie bereits vorherige Ausführungen gezeigt haben, müssen die Enzyme sehr schnell wieder für erneute Reaktionen zur Verfügung stehen.
|
- weiter zu Teil-2
- Teil-2
- 5. Regulation der Enzymaktivität
- 6. Enzyme in jedem Lebensbereich

Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung – Weitergabe unter gleichen Bedingungen 4.0 International Lizenz.