Exkurs – B / Teil-2
Enzyme – ohne sie geht gar nichts!
Inhalte:
Kompetitive Hemmung / Nicht-kompetitive Hemmung / Allosterische Hemmung u. Förderung / Endprodukthemmung / Enzym Auf- u. Abbau /
Aktivierung u. Inaktivierung / Faktor Temperatur / Faktor pH-Wert / Substrat-Enzym-Verhältnis
Die zurückliegenden Abschnitte haben gezeigt, wie Enzyme aufgebaut sind und wie sie grundsätzlich arbeiten.
Im folgenden Abschnitt soll deutlich werden, dass Enzyme nicht immer gleich arbeiten. Ihre Arbeit wird „ausgebremst“ oder auch „gefördert“. Verantwortlich dafür ist vor allem der Bedarf an bestimmten Stoffen im Organismus zu einem bestimmten Zeitpunkt an einem bestimmten Ort.
Ein Molekül, das an ein Enzym bindet und dadurch dessen Aktivität ändert, nennt man Effektor. Dabei wird unterschieden zwischen solchen Molekülen, die eine Aktivität hemmen (= Inhibitoren) und solchen, die die Aktivität fördern (= Aktivatoren). Aber auch äußere Faktoren, wie z.B. die Temperatur, beeinflussen enzymatische Prozesse. Zusammenfassend spricht man von der Regulation der Enzymaktivität.
Kompetitive (lat.: competitor „Mitbewerber“) Hemmung
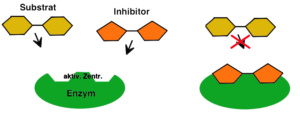
Dass Enzym und Substrat zusammenpassen müssen, damit eine Reaktion stattfindet, wurde bereits erläutert (siehe hier). In Zusammenhang mit der kompetitiven Hemmung kommt zusätzlich ein Inhibitor (lat.: inhibere „hemmen“) ins Spiel.
Das Besondere an diesem Inhibitor ist, dass seine molekulare Struktur dem des Substrates – zumindest in Teilen – sehr ähnlich ist.
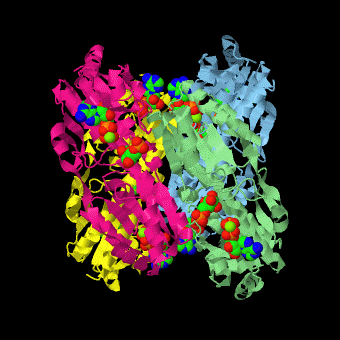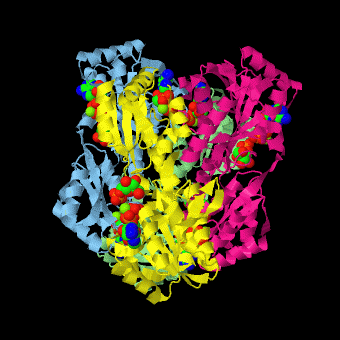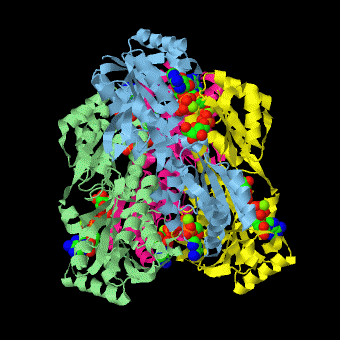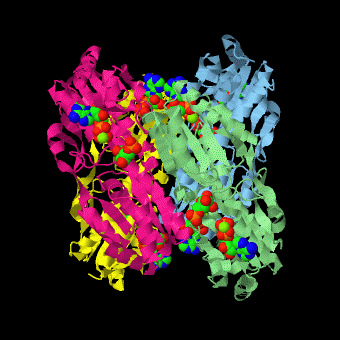
Am aktiven Zentrum des Enzyms kann daher die Situation auftreten, dass der Inhibitor eine Verbindung mit dem Enzym eingeht und das Substrat dann nicht mehr binden kann, weil die Bindungsstelle bereits besetzt ist. (Abb. EB_5-1). Bei gleichzeitigem Vorhandensein von Substrat und Inhibitor konkurrieren beide also um die Bindungsstelle am Enzym.
Entscheidend in Hinblick auf die „Konkurrenz“ zwischen Substrat und Inhibitor ist deren jeweilige Menge. Derjenige Stoff – Substrat oder Inhibitor -, der in größerer Menge vorliegt, hat vor allem eine größere Chance auf das Enzym zu treffen. Von diesem Stoff werden dann pro Zeiteinheit mehr Moleküle enzymatisch umgesetzt als von dem Stoff, der in geringerer Menge vorliegt.
Die kompetitive Hemmung ist reversibel (= umkehrbar), d.h. die Bindung zwischen Inhibitor und Enzym kann wieder gelöst werden.
Eine kompetitive Hemmung kann auch in Zusammenhang mit der Gruppenspezifität (siehe Teil 1 / Substratspezifität) eines Enzyms zum Tragen kommen. Verarbeitet ein Enzym also mehrere ähnliche Substrate, so konkurrieren auch diese beim gleichzeitigen Vorhandensein um die Bindung am Enzym. Ein Substrat kann also ein anderes, ähnlich aufgebautes Substrat blockieren bzw. hemmen und damit seine Verarbeitung reduzieren oder sogar verhindern.
spielen könnte. |
|
Menschen können gesundheitlich schwer geschädigt werden oder sogar zu Tode kommen, weil alkoholische Getränke mit Methanol oder Ethylenglykol vermischt werden. Beide Alkohole sind billiger als das normalerweise enthaltene Ethanol (C2H5OH). Das Tückische an solcher Panscherei ist, dass alle drei Stoffe im Geschmack kaum zu unterscheiden sind, vor allem wenn eine Spirituose weitere Geschmacksstoffe enthält.
Ethanol (C2H5OH) für Getränke wird durch die alkoholische Gärung mit Hilfe von Hefen aus zucker- oder stärkehaltigen Früchten bzw. Nutzpflanzen gewonnen. Dieser Alkohol kann gesundheitsschädlich sein und wird von der Weltgesundheitsorganisation als Droge eingestuft. Außerdem wird Ethanol für chemisch-technische Zwecke auch industriell über verschiedene Synthesewege hergestellt. Das so gewonnene Ethanol ist allerdings stark gesundheitsschädlich bis tödlich.
Methanol (CH3OH) wird industriell vor allem aus Methangas hergestellt. Es entsteht aber auch als Nebenprodukt der alkoholischen Gärung. Methanol dient z.B. als Lösungsmittel in Farben. Es wird auch als Scheibenwischer-Zusatzmittel eingesetzt. Methanol ist stark gesundheitsschädlich bis tödlich.
Ethylenglykol (C2H4(OH)2) wird aus dem Gas Ethen gewonnen. Es wird in der Kunststoffindustrie eingesetzt und kommt auch in Frostschutzmitteln für Kraftfahrzeuge zum Einsatz. Ethylenglykol ist stark gesundheitsschädlich bis tödlich.
Alle drei Stoffe werden vor allem in der Leber durch das Enzym Alkoholdehydrogenase (ADH) verstoffwechselt. Das heißt, alle drei Substrate können am aktiven Zentrum dieses Enzyms binden und werden dort „verarbeitet“. Allerdings entstehen – nach weiteren enzymatischen Prozessen – je nach Ausgangssubstrat unterschiedliche Folgeprodukte (Abb. EB_5-2). Die Folgeprodukte der enzymatischen Ethanolverarbeitung – vor allem Essigsäure – werden z.B. zur Energiegewinnung genutzt. Methanol führt zur Bildung von Formaldehyd und letztlich – über verschiedene Zwischenprodukte – zu Ameisensäure. Aus dem Ausgangsstoff Ethylenglykol entsteht als Folgeprodukt vor allem Oxalsäure.
Die drei Stoffe Formaldehyd, Ameisensäure und Oxalsäure sind äußerst schädlich für den Körper (Nierenversagen, Netzhautzerstörung, etc.) und bedeuten im schlimmsten Fall den Tod.
| Lösung zu Aufg. 15
Unter medizinischer Aufsicht (!) wird dem Körper der betroffenen Person eine bestimmte Menge Ethanol über einen gewissen Zeitraum zugeführt. Dieses konkurriert dann mit den Stoffen Methanol oder Ethylenglykol um das Enzym ADH. Das Ziel ist, dass durch die „häufigere Belegung“ des Enzyms ADH mit Ethanol möglichst wenig der schädlichen Stoffe aus einer der beiden anderen Ausgangssubstanzen entstehen können. |
Nicht-kompetitive Hemmung
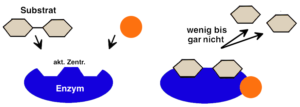
Bei der nicht-kompetitiven Hemmung bindet der Inhibitor außerhalb des aktiven Zentrums des Enzyms an einzelne Aminosäuren und führt damit zu einer Veränderung der Raumstruktur bzw. Tertiärstruktur des Proteins.
Der entscheidende Unterschied zur kompetitiven Hemmung ist, dass eine Substratbindung zwar weiterhin möglich ist, die Enzymwirkung jedoch vermindert oder sogar inaktiviert ist.
Der Vorgang ist in der Regel irreversibel (= nicht umkehrbar). Das bedeutet, dass die Auswirkung erst dann aufhört, wenn neue Enzyme gebildet wurden und die Menge der Inhibitoren für die „Besetzung“ der vorhandenen Enzyme im Verhältnis abnimmt.
Einige dieser Inhibitoren sind nicht sehr enzymspezifisch, d.h. unterschiedlichste Enzyme können von ihnen nicht-kompetitiv gehemmt werden. Das ist u.a. der Fall bei Schwermetall-Ionen (Hg2+, Cd2+, Pb2+ etc. ). Sie haben eine hohe Affinität (= lat.: affinis „Komplize“, „Neigung zu etwas“) mit den Disulfidbrücken eines Proteins (siehe hier) Verbindungen einzugehen.
Andere nicht-kompetitiv hemmende Stoffe wirken dagegen verstärkt auf sehr spezielle Enzyme. Dazu gehören u.a. einige chemische Kampfstoffe, wie z.B. das Sarin.
Beispiel:
Das Medikament Aspirin enthält den Wirkstoff Acetylsalycilsäure (ASS). Es wird für verschiedene Zwecke, unter anderem zur Schmerzlinderung, eingesetzt. In diesem Zusammenhang ist es ein Beispiel für eine nicht kompetitive Hemmung.
Das Enzym COX1 ist dafür verantwortlich, dass von den Schmerzsinneszellen kommende Signale weitergeleitet werden. Zu diesem Zweck stellt das Enzym aus einem bestimmten Substrat ein spezifisches Produkt her. Der Stoff ASS hemmt dieses Enzym, indem es in der Nähe des aktiven Zentrums irreversibel an eine der dort vorhandenen Aminosäuren – Serin – bindet. Die dadurch auftretende Veränderung in der räumlichen Struktur von COX1 bindet zwar noch das umzuwandelnde Substrat, verhindert jedoch die Entstehung des Produktes, das für die Weiterleitung der Schmerzsignale zuständig ist. Die Schmerzwahrnehmung wird reduziert.
Lösungen zu Aufg. 16 u. 17
|
Allosterische Hemmung / Förderung
Die in der Überschrift stehenden Begriffe widersprechen sich. Das verwirrt vielleicht! Die folgende Alltagsgeschichte geht darauf ein. Zu beachten ist, dass sie lediglich eine Verständnishilfe ist, die zu den eigentlichen Inhalten hinführen soll!
| Stelle dir eine Firma vor, die viel mehr Smartphones produziert, als sie verkaufen kann. Wenn sie so weiter produziert, wird sie bald pleitegehen, weil sie viel Energie und teure Stoffe zur Produktion einsetzen muss. Also muss die Firma die Menge der herzustellenden Smartphones dem Bedarf anpassen. Sie wird die Maschinen zur Produktion der Smartphones runterfahren oder sogar stilllegen. Auch alle Stoffe im Körper haben ihren Wert. Der Körper benötigt Energie und Material, um Stoffe herzustellen. Auch hier muss bei einer Überproduktion eines Stoffes eingegriffen werden. Im Falle der allosterischen Hemmung bedeutet dieses die Verminderung oder sogar Einstellung der Aktivität des Enzyms, das für die Produktion dieses Stoffes zuständig ist. Nach Entwicklung einer neuen Produktlinie wird der Wunsch nach Smartphones von unserer gedachten Firma plötzlich wieder steigen. Dann macht es Sinn die stillgelegten Maschinen für die Produktion wieder in Betrieb zu nehmen. Eine vergleichbare Situation ist auch in unserem Körper anzutreffen. Plötzlich wird ein Stoff knapp und das Enzym, das für die Produktion dieses Stoffes zuständig ist, wird nun unterstützt, wieder aktiv zu werden. Damit liegt eine allosterische Förderung der Enzymaktivität vor. |
Bei der allosterischen (griech.: allos „anders“ / stereós „Ort“, „am anderen Ort“) Hemmung bzw. Förderung sind vier Gegebenheiten maßgeblich:
- Es gibt außer dem aktiven Zentrum eine zweite „Andockstelle“ (= allosterisches Zentrum), an der ein Inhibitor oder ein Aktivator wirksam werden können.
- Die räumliche Struktur des aktiven Zentrums wird verändert, so dass das Substrat gar nicht, schlechter oder besser binden kann.
- Die Verbindung zwischen dem jeweiligen Inhibitor oder Aktivator und dem Enzym ist reversibel.
- Die Arbeit dieser Enzyme ermöglicht eine sehr feine Regulation der Enzymaktivität, denn sie arbeiten wie „Ein- und Ausschalter“, indem sie sehr empfindlich auf die vorhandene Substratkonzentration reagieren.
Beispiel:
Die folgenden Ausführungen beschreiben einen vereinfacht dargestellten Ausschnitt für das Zusammenspiel einer allosterischen Hemmung bzw. Förderung zur Regulation eines Stoffwechselprozesses.
Es geht dabei um die Energiegewinnung in Form von ATP (= „Treibstoff der Stoffwechselvorgänge“) aus dem energiereichen Molekül Glucose. (siehe auch Kap. 5.1).
Zum besseren Verständnis die folgenden Informationen.
Vorabinformationen:
- Nach der Nahrungsaufnahme und der sich anschließenden Verdauung werden energiereiche Stoffe, vor allem Kohlenhydrate und Fette, im Stoffwechsel verarbeitet, um schließlich in Form von Glucose zur Energiegewinnung genutzt zu werden. Ziel ist die Bildung des energiereichen Stoffes ATP, dem Treibstoff des Stoffwechsels.
- Nachdem ATP (Adenosintriphosphat) für energieverbrauchende Vorgänge im Stoffwechsel genutzt wurde, liegt es als ADP (Adenosindiphosphat) und ein einzelnes Phosphatmolekül vor. ADP besitzt also eine Phosphatgruppe weniger als ATP und ist damit etwas energieärmer als ATP.
Der Vorgang:
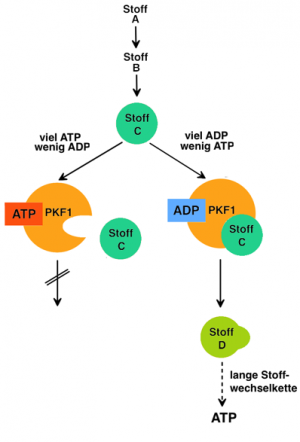
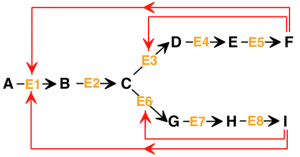
Um die Glucose – nennen wir sie Stoff A – für die am Ende einer langen Stoffwechsel-Kette stehenden ATP-Gewinnung verwertbar zu machen, wird sie zunächst enzymatisch in den Stoff B umgewandelt, dieser in den Stoff C, usw. Es folgen viele weitere Prozessschritte, bis am Ende die in der Glucose gespeicherte Energie in Form von ATP vorliegt.
Für die enzymatische Umwandlung von Stoff C in den Stoff D ist das Enzym Phosphofructokinase-1 (PKF1) verantwortlich. Dabei handelt es sich um ein allosterisches Enzym, das sowohl gehemmt als auch gefördert werden kann. Dabei wirken das ATP als Inhibitor und das ADP als Aktivator. Sie regulieren damit die am Ende der Stoffwechselkette stehende Gewinnung von ATP.
a-Beschreibe und erläutere die Abbildung unter Verwendung der Fachbegriffe. (Falls du eine Info zum Begriff „negative Rückkopplung“ benötigst, siehe hier) |
||
| *Fachlich weiterführende Ausführungen zum Enzym Phosphofructokinase finden sich u.a. hier: https://de.wikipedia.org/wiki/Phosphofructokinase_1 (Zugriff: 2017-10-25) http://flexikon.doccheck.com/de/Phosphofructokinase (Zugriff: 2017-10-25) http://www.chemie.de/lexikon/Phosphofructokinase.html (Zugriff: 2017-10-25) |
||
| Lösungen zu Aufg. 19 a-c
zu 19a |
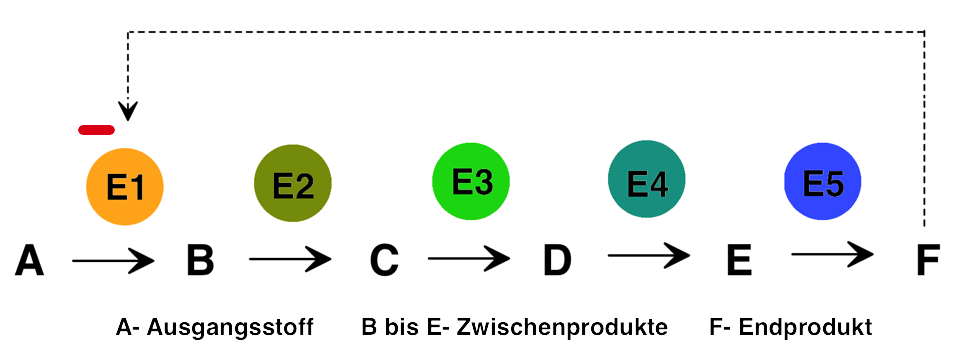
Endprodukthemmung (Feedback Inhibition)
In Zusammenhang mit den zuvor abgehandelten Enzymreaktionen wurde bereits deutlich, dass es nicht sinnvoll ist, einen Stoff bei ausreichendem Vorhandensein weiter herzustellen. Im engeren Sinne meint die Endprodukthemmung (Abb. EB_5-7) nichts anderes.
Die Endprodukthemmung ist ein Regulationsmechanismus im Stoffwechsel. Das Prinzip besteht darin, dass das Endprodukt einer enzymatischen Reaktionskette den ersten Schritt in der Reaktionskette im Sinne einer negativen Rückkopplung hemmt. Damit bietet die Endprodukthemmung ebenfalls die Möglichkeit, enzymatische Vorgänge ein- und auszuschalten bzw. stufenlos zu regulieren.
Die Art der Hemmung kann sowohl kompetitiv als auch allosterisch erfolgen. Sie ist in der Regel reversibel.
Der Begriff „Endprodukthemmung“ wird jedoch nicht nur in Zusammenhang mit einer einfachen (= linearen) Reaktionskette benutzt.
Im erweiterten Sinne wird dieser Begriff auch bei der Hemmung
- eines nicht am Anfang der Reaktionskette stehenden bzw. wirksamen Enzyms durch das Endprodukt und
- von End- oder Zwischenprodukten in verzweigten Reaktionswegen
benutzt.
|
||
|
||
Beispiele:
In den Beispielen geht es vor allem darum, die Produktion eines Stoffes seinem Bedarf möglichst genau anzupassen.
Die Erläuterungen erfolgen vereinfacht, auf biochemische Einzelheiten wird verzichtet.
- Im Rahmen der Energiegewinnung aus Glucose in Form von ATP hemmt eine ausreichende Menge an ATP eines der Enzyme in der Reaktionskette (siehe auch Abb. EB_5-5).
- Verdauungsenzyme werden sinnvollerweise nur dann in Mund, Magen, Bauchspeicheldrüse und Dünndarm synthetisiert, wenn sie benötigt werden. Je mehr von ihnen vorhanden ist, desto stärker wird ihre Synthese oder auch ihre Aktivierung (siehe hier) gehemmt.
- Die in der Proteinbiosynthese (siehe hier) benötigten Aminosäuren werden durch enzymatische Prozesse für diesen Vorgang „gebrauchsfertig“ gemacht. Sind ausreichende Mengen einer Aminosäure vorhanden, so wirkt deren Menge wiederum hemmend auf die an ihrer Bereitstellung beteiligten Enzyme.
Aufbau und Abbau von Enzymen
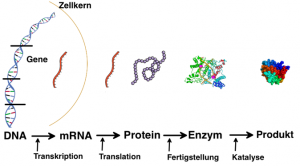
Es wird leicht übersehen, dass Enzyme nicht vom Himmel fallen, d.h. sie müssen hergestellt werden. Ihr entscheidender Bestandteil sind immer Proteine. Dementsprechend sind Enzyme letztlich ein Ergebnis der Proteinbiosynthese (Abb. EB_5-9).
Dieser Vorgang muss natürlich reguliert werden, um zu gewährleisten, dass nur dem Bedarf entsprechend die Proteine für ein spezifisches Enzym in einer bestimmten Menge synthetisiert werden. Das bedeutet, dass die Proteinbiosynthese in einem bestimmten Abschnitt gegebenenfalls eingestellt oder aktiviert werden muss. An diesen Regulationsprozessen sind ebenfalls Enzyme beteiligt.
Beispiel:
Cholesterin hat als Membranbestandteil und als Ausgangsprodukt zur Synthese weiterer wichtiger Stoffe eine große Bedeutung für unseren Organismus (siehe hier). Es wird vor allem in der Leber über einen Weg hergestellt, an dem viele Enzyme beteiligt sind und gelangt dann ins Blut.
Die Regulation der Cholesterinsynthese bzw. des -gehaltes im Blut beruht auf folgenden Vorgängen:
- Die Informationen für den Aufbau der an der Synthese beteiligten Enzyme liegen in bestimmten Genen der DNA.
- Diese Gene werden abgelesen (= Transkription) und die entstandene mRNA ist Grundlage für die Herstellung des Proteinanteils der zuvor erwähnten Enzyme.
- Das Ablesen der Gene erfolgt mit Hilfe bestimmter Proteine (= Regulatorproteine).
- Ein anderes Enzym ist in der Lage mit diesen Regulatorproteinen zu reagieren.
- Seine enzymatische Leistung besteht darin, dass es die Regulatorproteine hemmt, wenn genug Cholesterin hergestellt worden ist.
- Dementsprechend wird keine mRNA für die zur Cholesterinsynthese notwendigen Enzyme mehr gebildet.
- Aufgrund der nun fehlenden Enzyme wird auch kein Cholesterin mehr synthetisiert.
- Der Cholesteringehalt im Blut nimmt ab.
Anmerkung:
Dieser Prozess hat nichts mit dem Cholesterinwerten (HDL/LDL) in Zusammenhang mit der Ernährung zu tun (siehe hier).
|
Natürlich werden Enzyme, die nicht mehr benötigt werden, auch wieder abgebaut. Der Abbau erfolgt durch spezielle Enzyme, den Proteasomen. Sie leisten gewissermaßen eine „Qualitätkontrolle“, die jedoch nicht nur „fehlerhaft“ gebaute“ Enzyme, sondern auch nicht mehr benötigte Enzyme betrifft. Allerdings beschränkt sich ihr Vorkommen auf den Zellkern. In tierischen Zellen übernehmen außerhalb des Zellkerns bestimmte Zellorganellen, die Lysomen (griech. lysis „Auflösung“), den Abbau von nicht mehr benötigten Zellbestandteilen, also auch überflüssigen Enzymen. Es handelt sich dabei um winzige Bläschen mit eigener Membran (= Vesikel), die größere Moleküle in sich aufnehmen können (siehe hier). In ihrem Inneren befinden sich u.a. Proteasen. |
Aktivierung / Inaktivierung von Enzymen
Die Tätigkeit von Enzymen gilt es auch deshalb zu regulieren, weil ihr Auftreten dem Menschen schaden könnte – ja, das gibt es!
Beispiel:
Pepsin und Trypsin sind sogenannte Verdauungsenzyme. Pepsin zerlegt mit der Nahrung aufgenommene Proteine enzymatisch in größere Einzelteile. Besonders beim Auftreten bestimmter Aminosäuresequenzen (z.B. Phe–Phe, Phe–Tyr, Tyr–Phe, Tyr–Tyr) „zerschneidet“ es das Protein. Das Problem besteht darin, dass Pepsin nicht unterscheiden kann, ob es sich um ein Protein in Zusammenhang mit der Nahrungsaufnahme, das abgebaut werden soll oder um ein körpereigenes Protein handelt. Es könnte zur „Selbstverdauung“ kommen! Letzteres wäre nicht gut!
Aus diesem Grund produzieren Drüsenzellen in der Magenschleimhaut, die selbst Proteine enthalten, zunächst eine inaktive Vorstufe (= Proenzym) des Pepsins, das Pepsinogen. Eine Selbstverdauung der Proteine in den Drüsenzellen der Magenschleimhaut wird somit verhindert. Erst der pH-Wert von 1- 2 (stark sauer) des Magensaftes führt dazu, dass Teile des Pepsinogens so verändert werden, dass das aktive Pepsin entsteht. Die Magenschleimhaut selbst ist unempfindlich gegenüber Pepsin, es sei denn, es liegt eine Magenschleimhautentzündung vor.
Damit aber nicht genug! Das Pepsin gelangt unweigerlich durch den Magenausgang (= Pförtner) in den Dünndarm. Damit dessen Zellen vom Pepsin nicht angegriffen werden, herrscht dort ein pH-Wert von 6 – 8. Dieses führt zur erneuten Inaktivierung des Pepsins. Als regulierender Faktor wirkt in diesem Fall der pH-Wert (siehe hier).
Auch bei anderen Enzymen, die für die Proteinverdauung zuständig sind, gibt es ähnliche Regulationsmechanismen.
| Lösungen zu Aufg. 21 und 22
zu 21 |
Äußere Faktoren
Neben der Tatsache, dass der Bedarf an zu produzierenden bzw. um- und abzubauenden Substanzen die Aktivitäten von Enzymen maßgeblich beeinflusst, gibt es eine fast unüberschaubare Vielzahl von äußeren Faktoren, die auf die Leistungsfähigkeit der Enzyme wirken.
Faktor Temperatur
Bei wechselnden Temperaturen verringert bzw. beschleunigt sich die Aktivität der Enzyme. Der Faktor Temperatur bietet somit eine Möglichkeit, die Enzymaktivität zu regulieren. Ursache ist die sogenannte RGT-Regel.
Die RGT-Regel (Reaktionsgeschwindigkeits-Temperatur-Regel) gilt für fast alle chemischen Prozesse in der unbelebten und belebten Natur. Sie beschreibt den Zusammenhang zwischen der Zunahme der Reaktionsgeschwindigkeit chemischer Prozesse und steigender Temperatur. Als Faustregel gilt, dass sich die Geschwindigkeit einer Reaktion bei einer Temperaturerhöhung um 10oC verdoppelt bis verdreifacht.
Vereinfacht ausgedrückt beruht die RGT-Regel darauf, dass sich Teilchen (Moleküle, Atome) mit zunehmender Temperatur schneller bewegen. Dadurch „stoßen“ sie häufiger aufeinander.
Für Prozesse in der belebten Natur gilt diese Regel aber nur für einen begrenzten Temperaturbereich.
Bei 0oC arbeiten Enzyme in der Regel nicht mehr. Bei den meisten Lebewesen beschleunigt sich die Aktivität der Enzyme langsam bis in den Bereich von etwa 37oC. Sie arbeiten dann in einem optimalen Bereich. Bei höheren Temperaturen fällt die Aktivitätskurve relativ schnell wieder ab.
(siehe auch: V EB_5 „Katalase – Kälte und Hitze nicht erwünscht!“)
Die grafische Darstellung der Wirkung eines äußeren Faktors auf die Arbeits- bzw. Leistungsfähigkeit eines Enzyms wird meistens in Form einer sogenannten Toleranzkurve dargestellt. |
||
|
||
Beispiel:
Da fast alle Lebensprozesse von Enzymen beeinflusst werden, zeigt sich die Aktivität der Enzyme in Zusammenhang mit der Temperatur auch am „ganzen“ Lebewesen.
Vorinformationen
a-Beschreibe die beiden Kurven und berücksichtige dabei die zuvor angesprochene temperaturabhängige Aktivität der Enzyme. |
||
|
||
Faktor pH-Wert
Die Fähigkeit von Enzymen, bei einem bestimmten pH-Wert optimal zu arbeiten, ist ebenfalls eine Möglichkeit, deren Leistungen positiv oder negativ zu beeinflussen.
Der pH-Wert im Blut sowie in den Gewebe- bzw. Zellflüssigkeiten bleibt selbst bei wechselnden Umweltbedingungen relativ konstant. Er beträgt im Mittel 7,36 bis 7,41. Werte, die unter 7,0 oder über 7,8 liegen, führen zu schweren körperlichen Schäden oder sogar zum Tode.
Die meisten Enzyme arbeiten nur im genannten mittleren Bereich. Es gibt aber Ausnahmen, bei denen Enzyme bei pH-Werten arbeiten, die deutlich vom mittleren Bereich abweichen.
Ein hoher pH-Wert ist gekennzeichnet durch eine niedrige H+-Ionenkonzentration (wenig Säure), ein niedriger pH-Wert durch eine hohe H+-Konzentration (viel Säure).
Die Skala des pH-Wertes reicht von pH 1 (stark sauer) über pH 7 (neutral) bis pH 14 (stark basisch).
Nur in einem bestimmten Bereich des pH-Wertes sind die Leistungen eines jeden Enzyms optimal.
Je nach Änderungsgrad des pH-Wertes kommt es vor allem zu einer mehr oder weniger starken Veränderung in den Aminosäureresten (= Seitenketten) der Aminosäuren. Damit verbunden ist z.B. die Zerstörung von Wasserstoffbrückenbindungen. Die Folge ist eine Änderung in der räumlichen Anordnung der Moleküle und damit eine veränderte Tertiärstruktur.
Davon kann auch das aktive Zentrum betroffen sein. Das hat zur Folge, dass das Substrat schlechter oder gar nicht mehr an das aktive Zentrum des Enzyms binden kann. Die Enzymaktivität wird dadurch vermindert oder ganz eingestellt.
(siehe auch: V EB_6 „Katalase – Zitrone oder Waschmittel bevorzugt?“)
Beispiel:
Substrat-Enzym-Verhältnis
Wie die Enzymaktivität durch die Menge des Substrates beeinflusst wird, damit beschäftigt sich die sogenannte Enzymkinetik (griech.: kínesis „Bewegung“). Die damit verbundenen fachlichen Grundlagen werden an dieser Stelle stark vereinfacht beschrieben. Genaueres muss der Chemieunterricht liefern.
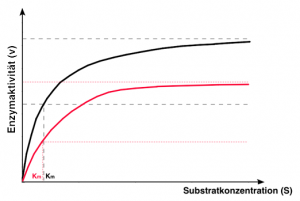
Die Abbildung EB_5-14 stellt die Abhängigkeit der Enzymaktivität von der Substratmenge dar. Bildlich ausgedrückt lässt sich der dargestellte Sachverhalt folgendermaßen beschreiben:
Hat man vier Enzymmoleküle eines Enzymtyps und kein Substrat, beträgt die Aktivität der Enzyme null, denn kein Substrat wird chemisch verändert. Nun werden Substratmoleküle hinzugegeben. Die Enzyme bilden nun mit den Substratmolekülen jeweils Enzym-Substrat-Komplexe.
Zu einem bestimmten Zeitpunkt ist die Hälfte aller Enzyme mit Substratmolekülen besetzt. Sind alle vier Enzyme mit Substratmolekülen besetzt, ist die maximale Aktivität der Enzyme erreicht. Eine weitere Zugabe von Substratmolekülen hat dann keinen Einfluss mehr auf die Enzymaktivität, da keine weiteren Enzym-Substrat-Komplexe gebildet werden können.
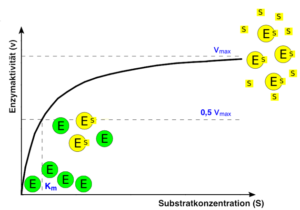
Abb. EB_5-14 Abhängigkeit der Enzymaktivität von der Substratkonzentration / Michaelis-Menten-Konstante
Die beiden Wissenschaftler L. Michaelis und M. Menten beschrieben Anfang des 20. Jh. erstmals diese Zusammenhänge. Die maximale Aktivität wird demnach Vmax genannt. Die Substratmenge, die bei der halben maximalen Enzymaktivität (= 0,5 Vmax) in Form von Enzym-Substrat-Komplexen vorliegt, wird seitdem als Km (= Michaelis-Menten-Konstante) bezeichnet.
Ist der Km-Wert niedrig, so liegt die halbmaximale Aktivität des betreffenden Enzyms bereits bei geringer Substratmenge vor. Dieses Enzym ist somit stark affin (lat.: affinis „Komplize“, „Neigung zu etwas“) zu dem Substrat. Ist der Km-Wert hoch, so wird die halbmaximale Aktivität erst erreicht, wenn das Angebot an Substratmolekülen relativ groß ist. Dieses Enzym ist dementsprechend gering affin zu diesem Substrat.
Somit wird es möglich, mit Hilfe des Km-Wertes die Leistungsfähigkeit von Enzymen miteinander zu vergleichen.
Für gruppenspezifisch arbeitende Enzyme gilt, dass sie hinsichtlich der verschiedenen Substrate auch unterschiedliche Km-Werte aufweisen.
|
||
|
||
Ein weiterer Wert, der in diesen Zusammenhängen über die Leistungsfähigkeit eines Enzyms Auskunft gibt, ist die „Wechselzahl“. Sie gibt an, wie viele Substratmoleküle ein Enzym in einem bestimmten Zeitraum verarbeiten kann. Diese Werte sind sehr unterschiedlich. Bei der Katalase kann dieser Wert bis zu 4.000.000 Substratmoleküle pro Sekunde betragen. Bei Trypsin sind es „nur“ 100 bis 1.000 Substratmoleküle pro Sekunde.
(siehe auch: V EB_7 „Katalase – „Hunger“ auf mehr?“ / V EB_8 „Mensch-Weizenpuffer-Modellversuch“)
|
||
a-Erkläre mit Hilfe dieser Information, warum die „Ethanol-Behandlung“ bei einer Methanol-Vergiftung erfolgreich ist. Beziehe die bereits an früherer Stelle gemachten Ausführungen zu einer Methanolvergiftung mit ein (siehe hier). |
||
|
||
| Menschen verwenden schon lange Enzyme zur Käseherstellung aus Milch, zum Gerben von Fellen oder zum Bierbrauen. Über Jahrtausende wussten sie nicht, dass dabei Enzyme immer eine entscheidende Rolle spielen. Heutzutage geht es in Zusammenhang mit der Nutzung von Enzymen kaum noch um Tätigkeiten in Form eines herkömmlichen Handwerkes. In der Regel bestimmen komplizierte Techniken gekoppelt mit leistungsfähigen Rechnern die Produktionsprozesse, bei denen Enzyme eingesetzt werden.
„Schon morgens nach dem Aufstehen begegnen uns möglicherweise Enzyme in unserer Zahnpasta oder Mundspüllösung. Dabei kann es sich um Lysozyme handeln, die Bakterien angreifen und auflösen oder um die Amyloglucosidase, die Stärkemoleküle zerlegt und die Aktivität anderer im Speichel enthaltener Enzyme, z.B. die Lactoperoxidase, fördert. Letztere trägt durch ihre Reaktionsprodukte ebenfalls zur Bekämpfung von Bakterien im Mundraum bei. Schon diese wenigen Zeilen mögen einerseits interessant klingen, zeigen jedoch andererseits die Komplexität der Bedeutung von Enzymen in verschiedenen Lebensbereichen. Im Rahmen dieses Exkurses soll versucht werden, das Vorkommen entsprechender Enzyme etwas zu strukturieren. Zu Übersichtsseiten zum Thema „Enzyme in allen Lebensbereichen“ führen u.a. folgende Links: |
An dieser Stelle sollen lediglich noch zwei Aspekte angesprochen werden, die für sehr viele in den verschiedenen Lebensbereichen auftretenden Enzyme eine große Rolle spielen.
- Warum begegnen uns eigentlich in allen Lebensbereichen Enzyme?
Dass Enzyme als „Werkzeuge“ in allen Lebensbereichen eine entscheidende Rolle spielen, ist vor allem auf die unbegrenzte Vielfalt der Proteine zurückzuführen (siehe AB 1_2.3). Diese wiederum hat ihren Ausgangspunkt in den unendlichen Kombinationsmöglichkeiten des genetischen Codes der DNA (siehe AB 2_2.3).
Folgen dieser Proteinvielfalt sind die „Substratspezifität“ und „Wirkungsspezifität“ (siehe …) der Enzyme. Beide Spezifitäten ermöglichen genaue und zielgerichtete Reaktionen unter Beteiligung der Enzyme und verschiedenster Substrate.
Wir nutzen viele Organismen bzw. deren Enzymaktivitäten, um zu existieren bzw. unser Leben zu vereinfachen. Gezüchtete und manipulierte Bakterien produzieren für uns Enzyme „nach Wunsch“. Außerdem profitieren wir von Enzymen, die nicht mehr an lebende Zellen gebunden sind. Diese werden mittels aufwendiger Prozesse aus Zellen gewonnen.
In diesem Zusammenhängen gewinnen neben der Mikrobiologie auch die Bereiche der Gen- und Biotechnologie eine immer größere Bedeutung. Da der Hauptbestandteil von Enzymen Proteine sind, spielt schließlich auch das Proteinengineering (siehe AB 15_2.3) bei der Erforschung, Herstellung und Nutzung neuer Enzyme eine immer größere Rolle. In diesem Zusammenhang wird auch von „Enzym-Design“ gesprochen.
- Welche Grundlagenkenntnisse sind hilfreich, um die heutige Bedeutung der Enzyme in allen Lebensbereichen besser zu verstehen?
Aufgrund des zuvor Gesagten ist es nützlich zu wissen, womit sich die drei Wissenschaftsgebiete „Mikrobiologie“, „Biotechnologie“ und „Gentechnologie“ vom Ansatz her befassen.
Die im Anschluss genannten Arbeitsmaterialien (AB Exk.-B) ergänzen und vertiefen nicht nur das Thema „Enzyme“, sondern behandeln auch deren vielfältige und interessante Bedeutung in fast allen Lebensbereichen.
Das AB EB_1 „Nussknacker und Flaschenöffner – Modelle für Enzyme?“ versucht auf einfache Art und Weise die Eigenschaften bzw. Wirkungsweisen von Enzymen zu veranschaulichen. Zwei einzusetzende Modelle werden vorgestellt, müssen aber auch kritisch hinterfragt werden. Allgemeine Informationen zu Modellen finden sich im Arbeitsmaterial FW 11 „Modelle verstehen“.
Das AB EB_2 „Enzyme und Gifte, Enzyme als Gifte – was ist ein Gift?“ verdeutlicht, dass Enzyme einerseits durch andere Stoffe in ihren Leistungen negativ beeinflusst werden können, andererseits aber auch bestimmte Enzyme selbst Lebensprozesse massiv stören können. In beiden Fällen handelt es sich um „Giftwirkung“. Der Begriff „Gift“ wird näher betrachtet und in Zusammenhängen mit Enzymen erläutert.
Im AB EB_3 „Neonicotinoide – ein Problem für Bienen, Hummeln und andere Insekten?“ wird der Einsatz von Insektiziden an einem Beispiel auf verschiedenen Ebenen (Ökosystem, Organismus, Zelle, Biochemie, Politik) behandelt.
Ergänzt wird dieses Arbeitsmaterial durch AB EB_3PL , ein Planspiel zum Thema „Neonicotinoide“.
Trotz ihrer weltweiten Ächtung werden chemischen Kampfstoffe auch heute noch in vielen Ländern gelagert. Nicht nur in Zusammenhang mit terroristischen Aktivitäten stellen sie eine große Gefahr dar. Das AB EB_4 „Chemische Kampfstoffe – schädigen und töten auch über Enzyme!“ beschreibt die grausame Wirkung der beiden Kampfstoffe „Sarin“ und „Nowitschok“ auf Enzymebene.
In vielen Bereichen ist es wichtig, unterschiedlichste Stoffe schnell und quantitativ zu erfassen. Dabei kommen auch Enzyme zum Einsatz, die als sogenannte Biosensoren arbeiten. Das AB EB_5 beschreibt die Leistungen von Enzym-Biosensoren anhand verschiedener Beispiele.
Weitere Arbeitsmaterialien (AB) zu den Enzymen werden erstellt.
……
Die Durchführung und Bearbeitung der folgenden Versuche soll die nicht immer einfach zu verstehende Theorie zum Thema „Enzyme“ etwas veranschaulichen.
|
[print_link]

Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung – Weitergabe unter gleichen Bedingungen 4.0 International Lizenz.